Questão 1
(Unesp) Três substâncias puras, X, Y e Z, tiveram suas condutividades elétricas testadas, tanto no estado sólido como no estado líquido, e os dados obtidos encontram-se resumidos na tabela.

Com base nessas informações, é correto classificar como substância(s) iônica(s)
a) Y e Z, apenas
b) X, Y e Z
c) X e Y, apenas
d) Y, apenas.
e) X, apenas
Questão 2
(Unifesp) A tabela apresenta algumas propriedades medidas, sob condições experimentais adequadas, dos compostos X, Y e Z.

A partir desses resultados, pode-se classificar os compostos X, Y e Z, respectivamente, como sólidos
a) molecular, covalente e metálico.
b) molecular, covalente e iônico.
c) covalente, molecular e iônico.
d) covalente, metálico e iônico.
e) iônico, covalente e molecular.
Questão 3
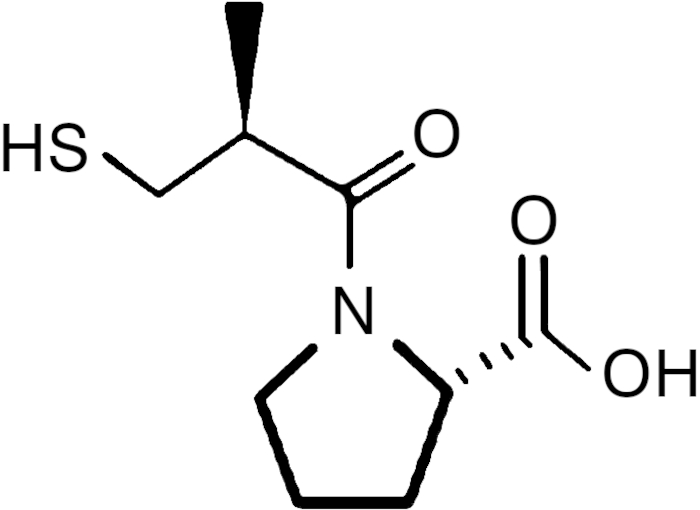
(PUC) O cloreto de magnésio (MgCℓ2) é um suplemento mineral que pode ser administrado, sob via oral, em humanos, com intuito de regular diversas funções no organismo. Já o captopril, cuja estrutura química está representada a seguir, é muito utilizado no controle da pressão arterial.
A respeito da ligação carbono-enxofre, observada na molécula do captopril, e da ligação presente no MgCl2, verifica-se que são, respectivamente,
a) iônica e covalente.
b) covalente e iônica.
c) covalente e metálica.
d) metálica e covalente.
e) iônica e metálica.
Questão 4
(PUC) As substâncias abaixo são exemplos de compostos formados por ligações iônicas, EXCETO:
a) NaCl(s)
b) MgSO4(s)
c) KI(s)
d) HCl(g)
Questão 5
Um estudante está analisando os compostos NaCl, CO2 e H2O. Ele observa que suas propriedades físicas são diferentes e deseja classificar o tipo de ligação presente em cada um deles. Qual(is) deles apresenta ligação iônica?
a) Apenas NaCl
b) Apenas CO2
c) Apenas H2O
d) NaCl e CO2
e) CO2 e H2O
Questão 6
Dado o elemento magnésio (Mg), com número atômico 12, e o elemento flúor (F), com número atômico 9, qual é a fórmula química do composto iônico formado entre eles?
a) Mg2F
b) MgF
c) MgF2
d) Mg3F2
e) Mg2F3
Questão 7
Dentre os compostos abaixo, quais são iônicos?
I) NaCl II) H2O III) KBr IV) CH4
a) I e II
b) II e IV
c) I, II e IV
d) III e IV
e) I e III
Questão 8
Analise as substâncias abaixo e classifique corretamente o tipo de ligação predominante:
I) LiBr
II) Fe (s)
III) O2
a) Iônica, metálica, covalente
b) Metálica, iônica, covalente
c) Iônica, covalente, metálica
d) Covalente, metálica, iônica
e) Covalente, iônica, metálica
Questão 9
Os compostos iônicos possuem características específicas. Sendo assim, qual das propriedades abaixo não é típica desses compostos?
a) Alta temperatura de fusão e ebulição
b) Boa condução elétrica no estado sólido
c) Solubilidade em água
d) Formação de redes cristalinas
e) Condução de eletricidade no estado líquido
Questão 10
Muitos compostos iônicos como, NaCl e K2SO4, são amplamente utilizados no cotidiano. Contudo, existem outros compostos não iônicos, como é caso das substâncias metálicas e moleculares. Em vista disso, qual das opções abaixo contém apenas compostos iônicos?
a) NaCl, H2O, NH3
b) Fe, K2SO4, NH3
c) K2SO4, CH4, H2O
d) NaCl, K2SO4, CaCO3
e) CaCO3, Fe, O2
Questão 11
Considere as ligações químicas em CaF2, O3 e H2SO4. Qual opção classifica corretamente os compostos em relação ao tipo de ligação?
a) Iônico, covalente, covalente
b) Covalente, covalente, covalente
c) Iônico, covalente, iônico
d) Metálico, iônico, covalente
e) Iônico, iônico, metálico
Questão 12
Durante um experimento, um aluno testou a condutividade elétrica de Al2O3 em diferentes estados. Ele observou que o composto conduziu eletricidade quando fundido, mas não no estado sólido. A explicação correta para isso é que no estado sólido:
a) o Al2O3 é metálico e, por isso, não conduz corrente.
b) os átomos compartilham elétrons, impedindo a condução de corrente.
c) os elétrons livres facilitam a condução elétrica.
d) as moléculas de Al2O3 compartilham elétrons para conduzir corrente.
e) os íons estão fixos na rede cristalina e não conduzem corrente elétrica.
Resposta Questão 1
Alternativa d
Primeiro devemos ter em mente as propriedades elétricas dos compostos iônicos: conduzem corrente elétrica tanto em meio aquoso, pela dissolução dos íons que formam o composto, quanto na forma líquida, ao serem fundidos. Entretanto, no estado sólido isso não ocorre. Posto isso, podemos eliminar X e Z, porquanto o primeiro conduz corrente elétrica no estado sólido, logo se trata de um metal; já o segundo não conduz nem no estado sólido nem no líquido, logo se trata de uma substância puramente molecular, restando apenas a substância Y.
Resposta Questão 2
Alternativa b
Tendo em vista que o composto Z não conduz eletricidade na fase sólida, mas conduz na fase líquida, então ele é um composto iônico. Logo, eliminam-se as alternativas “a” e “e”. Os compostos X e Y não conduzem eletricidade em nenhuma fase, o que significa que não são metais, eliminando-se a letra “d”. Para resolver o impasse entre “b” e “c” devemos entender que um composto molecular são todas as moléculas formadas por ligações covalentes, geralmente com baixos pontos de fusão. Já os compostos covalentes, restritos, são retículos formados por átomos sem formar moléculas, como é o caso do carbono diamante, com alta dureza e alto ponto de fusão. Em vista disso, podemos marcar a alternativa “b”
Resposta Questão 3
Alternativa b
O carbono e o enxofre são ametais, juntos formam ligações covalentes. Por outro lado, o magnésio (Mg) e o cloro (Cl) presentes no cloreto de magnésio são um metal e um ametal respectivamente, portanto a ligação entre eles é iônica.
Resposta Questão 4
Alternativa d
Primeiro, deve-se lembrar que ligações iônicas são formadas entre metais e ametais. Sendo assim, dentre as alternativas apresentadas, a única cuja substância não segue esse padrão é a letra “d”, pois o HCl tem hidrogênio (H) e cloro (Cl), que são ametais. Para reforçar, veja que nas outras alternativas temos Na+, Mg2+, K+ como metais e seus respectivos ânions ligantes, SO4+2-, I- e Cl-, como ametais, logo todos (a, b, c) são compostos iônicos.
Resposta Questão 5
Alternativa a
O NaCl é um composto iônico formado pela transferência de elétrons entre o metal sódio (Na) e o não metal cloro (Cl). Já CO2 e H2O são compostos moleculares com ligações covalentes formados por ametais.
Resposta Questão 6
Alternativa c
Primeiro é necessário saber quantos elétrons cada um deles possui em suas camadas de valência. O magnésio (Mg) tem configuração eletrônica 1s2 2s2 2p6 3s2, ou seja, possui 2 elétrons na camada de valência e forma Mg2+. O flúor (F) tem configuração 1s2 2s2 2p5, precisando de 1 elétron para completar a camada de valência, formando F⁻. Logo, o composto precisa de dois ânions F⁻ para equilibrar a carga do cátion Mg2+, resultando na fórmula MgF2.
Resposta Questão 7
Alternativa e
O NaCl e o KBr são compostos iônicos, formados por metais (Na e K) e não metais (Cl e Br). O H2O e o CH4, por outro lado, são compostos moleculares com ligações covalentes, isto é, formados apenas por ametais.
Resposta Questão 8
Alternativa a
O LiBr apresenta ligação iônica entre o metal Na e o não metal Cl. O Fe é um metal, com ligações metálicas entre os seus átomos. Já o O2 possui ligação covalente, com compartilhamento de elétrons entre dois átomos de oxigênio.
Resposta Questão 9
Alternativa b
Compostos iônicos não conduzem eletricidade no estado sólido, pois os íons estão fixos na rede cristalina. Logo, eles conduzem apenas no estado líquido ou em solução aquosa, quando os íons estão livres.
Resposta Questão 10
Alternativa d
Nesse caso deve-se marcar a alternativa que contém somente compostos formados por metais e ametais, ou seja, iônicos. Ao analisar cada caso, percebe-se que todos os compostos listados na alternativa “d” são formados por ligações iônicas entre cátions e ânions. As demais alternativas incluem compostos covalentes ou metálicos.
Resposta Questão 11
Alternativa a
CaF2 é iônico, formado por metal (Ca) e ametal (F). O O3 tem ligação covalente entre os átomos de oxigênio, ou seja, há o compartilhamento de elétrons. Já o H2SO4 também tem ligação covalente. Ou seja, os dois últimos são essencialmente formados apenas por ametais.
Resposta Questão 12
Alternativa e
O Al2O3 é um composto iônico que, assim como os demais, apresenta íons presos em uma estrutura cristalina no estado sólido, impedindo sua mobilidade e, consequentemente, a condução elétrica. No estado líquido, os íons estão livres, permitindo a condução de eletricidade.