Questão 1
(UEPB) 6,8 gramas de amônia (NH3) são aquecidos em um recipiente fechado a uma dada temperatura. Quando o sistema atinge o equilíbrio, verifica-se a formação de 0,6 grama de hidrogênio (H2). Qual é o grau de dissociação do NH3 nas condições da experiência? Dados: N = 14 e H = 1.
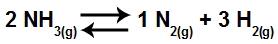
a) 50%
b) 40%
c) 30%
d) 20%
e) 10%
Questão 2
(UFMA) 2 mols de uma substância AB3(g) são aquecidos em um sistema fechado a uma determinada temperatura. 50% do composto dissocia-se e o equilíbrio é estabelecido de acordo com a equação abaixo:
2 AB3(g) → 1 A2(g) + 3 B2(g)
Qual a soma da quantidade de matéria das substâncias presentes na mistura no equilíbrio?
a) 3,0
b) 1,5
c) 2,0
d) 1,0
e) 2,5
Questão 3
Em um recipiente com capacidade (volume) fixa, foram adicionados 10 gramas da substância tetraóxido de dinitrogênio (N2O4) e, em seguida, aquecidos até a temperatura de 30oC. Com o aquecimento, ocorreu a formação do dióxido de nitrogênio, como mostrado a seguir:
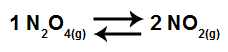
Sabendo que nessa temperatura o grau de dissociação do N2O2 é de 20%, determine a quantidade de NO2 no equilíbrio.
a) 0,064 mol
b) 0,024 mol
c) 0,034 mol
d) 0,044 mol
e) 0,054mol
Questão 4
Considere um sistema com capacidade de 2 L que contenha as substâncias X2, Y2 e XY em equilíbrio, a uma temperatura de 27 oC:
X2(g) + Y2(g) → 2 XY(g)
Foram colocados para reagir 0,10 mol de X2 com 0,6 mol de Y2. Determine o valor da constante do equilíbrio, sabendo que nessa temperatura o grau de dissociação do X2 é de 40 %.
a) 4,9.
b) 3,9.
c) 0,9.
d) 2,9.
e) 1,9.
Resposta Questão 1
Letra a). Dados fornecidos pelo exercício:
OBS.: Como não foi fornecido o volume do recipiente, sempre consideramos 1L.
-
Massa da amônia = 6,8g
-
Massa de hidrogênio = 0,6g
-
Massa atômica do nitrogênio = 14
-
Massa atômica do hidrogênio = 1
-
α = ?
1o Passo: Inicialmente é necessário calcular a massa molar das substâncias NH3 e H2 multiplicando a massa molar pela quantidade de átomos de cada elemento:
-
Para o NH3
M = 14.1 + 1.3
M = 14 + 3
M = 17g/mol
-
Para o H2
M = 1.2
M = 12 g/mol
2o Passo: Em seguida calculamos a quantidade de matéria (número de mol) do NH3 e do H2 dividindo a massa fornecida pelo exercício pela massa molar encontrada anteriormente:
-
Para o NH3
n = 6,8
17
n = 0,4 mol
-
Para o H2
n = 0,6
2
n = 0,3 mol
Antes de determinar o grau de dissociação, é necessário saber a quantidade de NH3 que sofreu dissociação. Para isso, temos o número de mol inicial de NH3 (0,4 mol) e temos o número de mol de H2 no equilíbrio. Agora basta relacionar com o balanceamento na seguinte tabela:
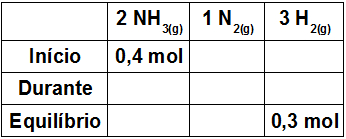
-
O início dos produtos é sempre 0, logo, no início, o H2 vale 0;
-
O valor do equilíbrio do H2 ou de qualquer produto é sempre a soma do início com o durante. Como o início é 0 e o equilíbrio é 0,3, logo, o durante vale 0,3 mol;
-
Para determinar o valor do durante do N2, basta dividir o valor encontrado no H por 3, porque a proporção entre eles é de 1 para 3. Logo, o valor do durante para o N2 é 0,1 mol e no seu equilíbrio também;
-
Para determinar o valor do durante do NH3, basta multiplicar o valor encontrado no N2 por 2, porque a proporção entre eles é de 2 para 1. Logo, o valor do durante para o NH3 é 0,2 mol. O valor do equilíbrio para o NH3 é dado pela subtração do início pelo durante, logo, temos 0,2 mol.
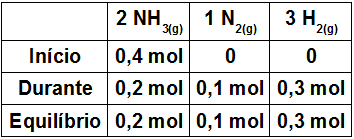
Por fim, para calcular o grau de dissociação, temos que dividir o número de mol do NH3 durante a reação pelo seu número de mol inicial:
α = 0,2
0,4
α = 0,5 mol
Multiplicando por 100 para transformar em porcentagem, temos 50% de dissociação.
Resposta Questão 2
Letra a). Dados fornecidos pelo exercício:
OBS.: Como não foi fornecido o volume do recipiente, sempre consideramos 1L.
-
a= 50%;
-
Número de mol de AB3 = 2 mol.
1o Passo: Inicialmente devemos utilizar o grau de dissociação para saber a quantidade de AB3 que sofreu dissociação. Para isso, multiplicamos o grau de dissociação pelo número de mol inicial fornecido pelo exercício:
n = 2.50%
n = 1 mol
2o Passo: Relacionar os valores inicial e durante do AB3 com o balanceamento na seguinte tabela:
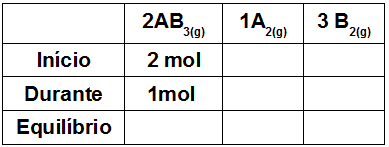
-
O início dos produtos é sempre 0, logo, no início, o H2 vale 0;
-
O valor do AB3 encontrado na dissociação de 50% é de 1 mol. O valor do equilíbrio para o AB3 é dado pela subtração do início pelo durante, logo, temos 1 mol;
-
Para determinar o valor do durante do A2, basta dividir o valor encontrado no AB3 por 2, porque a proporção entre eles é de 2 para 1. Logo, o valor do durante para o AB3 é 0,5 mol e no seu equilíbrio também;
-
Para determinar o valor do durante do B2, basta multiplicar o valor encontrado no B2 por 3, porque a proporção entre eles é de 1 para 3. Logo, o valor do durante para o B2 é 0,1,5 mol e no seu equilíbrio também.
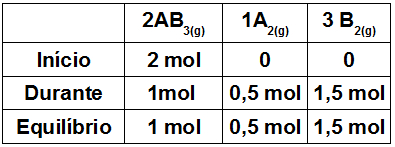
3o Passo: Por fim, basta somar os valores encontrados em cada equilíbrio:
Soma = 1 + 0,5 + 1,5
Soma = 3 mol
Resposta Questão 3
Letra d). Dados fornecidos pelo exercício:
OBS.: Como não foi fornecido o volume do recipiente, sempre consideramos 1L.
-
Massa de N2O4 = 10 g;
-
Massa atômica do nitrogênio = 14;
-
Massa atômica do oxigênio = 16;
-
α = 20%.
1o Passo: Inicialmente é necessário calcular a massa molar da substância N2O4 multiplicando a massa molar pela quantidade de átomos de cada elemento:
M = 14.2 + 16.4
M = 28 + 64
M = 92 g/mol
2o Passo: Em seguida calculamos a quantidade de matéria (número de mol) do N2O4 dividindo a massa fornecida pelo exercício pela massa molar encontrada anteriormente:
n = 10
92
n = 0,11 mol
3o Passo: Utilizamos o grau de dissociação para saber a quantidade de N2O4 que sofreu dissociação. Para isso, multiplicamos o grau de dissociação pelo número de mol inicial fornecido pelo exercício:
n = 0,11.20%
n = 0,022 mol
4o Passo: Para determinar a quantidade de NO2 no equilíbrio, é necessário utilizar a quantidade de N2O4 no início e a que sofreu dissociação e relacionar com o balanceamento na seguinte tabela:
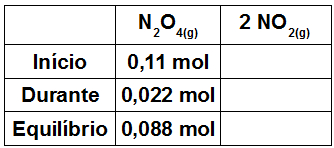
-
O início dos produtos é sempre 0, logo, no início, o NO2 vale 0;
-
O valor do equilíbrio do N2O4 é dado pela subtração do início pelo durante. Logo, no equilíbrio, temos 0,088 mol;
-
Para determinar o valor do durante do NO2, basta multiplicar o valor encontrado no N2O4 por 2, porque a proporção entre eles é de 1 para 2. Logo, o valor do durante para o NO2 é 0,044 mol e no seu equilíbrio também.
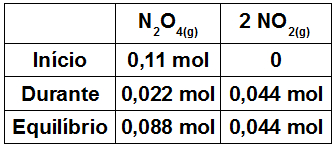
Resposta Questão 4
Letra e). Dados fornecidos pelo exercício:
-
V = 2L;
-
α = 40%;
-
Número de mol de X2 = 0,10 mol;
-
Número de mol de Y2 = 0,60 mol;
-
Kc = ?
1o Passo: Inicialmente devemos utilizar o grau de dissociação para saber a quantidade de X2 que sofreu dissociação. Para isso, multiplicamos o grau de dissociação pelo número de mol inicial fornecido pelo exercício:
nX2 = 0,1.40%
nX2 = 0,04 mol
2o Passo: Relacionar os valores inicial e durante do X2 com o balanceamento na seguinte tabela:

-
O início dos produtos é sempre 0, logo, no início, o XY vale 0;
-
O valor do equilíbrio do X2 é dado pela subtração do início pelo durante, logo, temos 0,06 mol;
-
Para determinar o valor do durante do Y2, basta igualar com o valor encontrado no X2, porque a proporção entre eles é de 1 para 1. Já no equilíbrio seu valor é 0,56 mol (dado pela subtração do início pelo durante);
-
Para determinar o valor do durante do XY, basta multiplicar o valor encontrado no Y2 por 2, porque a proporção entre eles é de 1 para 2. Logo, o valor do durante para o XY é 0,08 mol e no seu equilíbrio também.
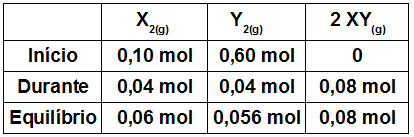
3o Passo: Antes de calcular o Kc, devemos dividir todos os valores presentes no equilíbrio por 2, já que o volume do recipiente é de 2L e o Kc utiliza valores em mol/L:
-
Para o X2:
[X2] = 0,06
2
[ X2 ] = 0,03 mol/L
-
Para o Y2
[Y2] = 0,056
2
[ Y2 ] = 0,028 mol/L
-
Para o XY
[XY] = 0,08
2
[ XY ] = 0,04 mol/L
4o Passo: Calcular o Kc com esta expressão:
Kc = [XY]2
[ X2 ].[ Y2 ]
Kc = [0,0016]
[0,00084]
Kc = 1,9



