Questão 1
(Uece 1ª Fase/2024.1) Efetuou-se a configuração eletrônica, em seu estado fundamental, de determinado elemento químico, cujos dados foram: nível 1 = completo; nível 2 = completo; nível 3 = completo; nível 4 = 18 elétrons; nível 5 = 6 elétrons.
Assim, é correto afirmar que esse elemento químico é o
(A) Sn (Z = 50).
(B) Sb (Z = 51).
(C) Te (Z = 52).
(D) I (Z = 53).
Questão 2
(Unicentro/2023) Dificilmente o cobalto é encontrado de forma pura na natureza, pois ele reage facilmente com oxigênio e cloreto, normalmente encontrado em cobaltita e eritrita. É utilizado para diversas finalidades, entre elas as ligas metálicas usadas em pás (hélices) de turbinas a gás, turbinas de aviões, como também em ímãs ou em cintas magnéticas. Representado pelo símbolo Co, esse elemento possui massa de 59 u e 32 nêutrons.
Assinale a alternativa que apresenta, corretamente, o número de elétrons do cobalto e sua respectiva distribuição eletrônica no estado fundamental.
(A) 1s2 2s2 2p6 3s2 3p6 4s2 3d7
(B) 1s2 2s2 2p6 3s2 3p6 4s2 3d10
(C) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
(D) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 5s2 4d9
(E) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f3
Questão 3
(PUC-RS Verão Medicina/2023) Uma célula nervosa transmite um sinal elétrico por meio de um mecanismo de transporte de íons sódio para fora da membrana celular e de íons potássio para dentro da membrana celular.
As configurações eletrônicas para os íons Na+ e K+ são, respectivamente,
(A) 1s2 2s2 2p6 e 1s2 2s2 2p6 3s2 3p6
(B) 1s2 2s2 2p6 3s2 e 1s2 2s2 2p6 3s2 3p6
(C) 1s2 2s2 2p6 3s1 e 1s2 2s2 2p6 3s2 3p6 4s1
(D) 1s2 2s2 2p6 3s2 e 1s2 2s2 2p6 3s2 3p6 4s2
Questão 4
(IME/2023-2024) Considere o esboço parcial da Tabela Periódica representado abaixo.
Sabe-se que um cátion trivalente apresenta o seguinte diagrama de preenchimento orbital:
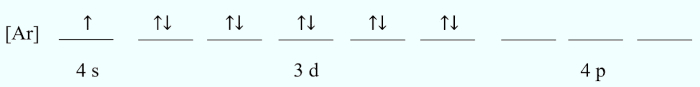
O elemento químico correspondente a esse cátion é o:
(A) Al
(B) Cu
(C) Ni
(D) Ge
(E) Se
Questão 5
O gás nobre neônio, Ne, apresenta a seguinte distribuição eletrônica por camadas: K = 2; L = 8.
Assinale a alternativa que contenha íons que apresentem a mesma distribuição eletrônica do neônio.
(A) Cl− e F−
(B) F− e Mg2+
(C) Cl− e Mg2+
(D) F− e Ca2+
(E) Sr2+ e Mg2+
Questão 6
“O Rio Doce está completamente morto, jogaram a Tabela Periódica inteira nele”. Tais palavras foram ditas Luciano Magalhães, diretor do Serviço Autônomo de Água e Esgoto (Saae) à época do caso da lama de rejeitos da Samarco, em 2015. Entre os contaminantes possíveis no rejeito, é possível encontrar metais como cobalto, cobre, manganês, níquel e cromo, todos na forma de cátions.
A partir dos metais citados no texto, identifique aquele que, com a carga 2+, apresentará a distribuição eletrônica 1s2 2s2 2p6 3s2 3p6 3d5.
(A) Co.
(B) Cu.
(C) Mn.
(D) Ni.
(E) Cr.
Questão 7
As cores dos fogos de artifício são consequência da presença de sais de elementos metálicos em sua composição. Por exemplo, sais de estrôncio entregam tons de vermelho enquanto sais de cobre entregam tons de azul. Já o metal alcalino sódio pode entregar bonitos tons de amarelo.
Apresente o conjunto de números quânticos do último elétron do íon sódio, Na+, presente em um sal utilizado para a confecção de fogos de artifício.
Dado: considere que o spin do 1º elétron a entrar no orbital é igual a − 1/2.
(A) n = 2; l = 1; ml = +1; s = +1/2.
(B) n = 2; l = 1; ml = 0; s = −1/2.
(C) n = 3; l = 0; ml = 0; s = +1/2.
(D) n = 3; l = 0; ml = 0; s = −1/2.
(E) n = 2; l = 2; ml = −2; s = +1/2.
Questão 8
Determinado átomo neutro possui a seguinte configuração para o seu elétron de maior energia.
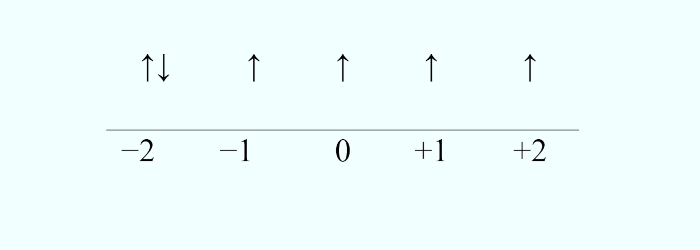
Com base no que foi exposto e sabendo que este é um elemento do quarto período da Tabela Periódica, indique o nome do elemento que possui essa configuração para seu elétron de maior energia.
(A) Manganês
(B) Ferro
(C) Tecnécio
(D) Rutênio
(E) Cobalto
Questão 9
O magnésio é a espécie responsável por dar a cor verde à clorofila e, consequentemente, às plantas. Essa estrutura é fundamental para a fotossíntese, transformando a energia da luz em solar em energia química, permitindo que as plantas possam, assim, produzir carboidratos e gás oxigênio.
Na clorofila, o magnésio está na forma do íon Mg2+.
A camada eletrônica em que se encontra o elétron de maior energia do magnésio é:
(A) K
(B) L
(C) M
(D) N
(E) O
Questão 10
Determinado elemento químico apresenta a configuração eletrônica igual a [Ne] 3s2 3p4.
Indique a alternativa que apresenta o número quântico principal (n) e o número quântico secundário do elétron de valência, respectivamente.
(A) 3 e 1.
(B) 3 e 2.
(C) 3 e 5.
(D) 5 e 3.
(E) 6 e 1.
Questão 11
Observe a configuração eletrônica de quatro elementos representativos no estado fundamental.
- 1s2 2s2 2p6 3s2 3p1
- 1s2 2s2 2p4
- 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
- 1s2 2s1
A partir do que foi exposto, é possível dizer que os elementos que correspondem aos números I, II, III e IV são, respectivamente:
(A) Alumínio, oxigênio, arsênio e lítio.
(B) Gálio, enxofre, fósforo e sódio.
(C) Alumínio, enxofre, nitrogênio e lítio.
(D) Gálio, oxigênio, arsênio e sódio.
(E) Alumínio, oxigênio, nitrogênio e lítio.
Questão 12
O cádmio, símbolo Cd e número atômico 48, é um metal estável no ambiente e muito tóxico. Boa parte do consumo desse metal está na confecção das baterias níquel-cádmio (NiCd).
O subnível de valência do cádmio é:
(A) 4d
(B) 3d
(C) 5s
(D) 4s
(E) 5p
Resposta Questão 1
Resposta: Letra C.
O elemento em questão está no seu estado fundamental. Assim, seu número de elétrons é igual ao seu número de prótons (que é o número atômico). O elemento descrito possui K = 2; L = 8; M = 18, N = 18 e O = 6, o que totalizam 52 elétrons e, consequentemente, 52 prótons. O elemento com número atômico igual a 52 é o Te.
Resposta Questão 2
Letra A.
O cobalto possui A = 59 e 32 nêutrons, assim é possível determinar, pela fórmula A = Z + n, que o número de prótons é igual a 27. Em seu estado fundamental, o número de prótons é igual ao número de elétrons e, assim sendo, o cobalto possui 27 elétrons.
A distribuição então é 1s2 2s2 2p6 3s2 3p6 4s2 3d7.
Resposta Questão 3
Letra A
O sódio, na forma Na+, fica com apenas 10 elétrons. Assim, sua configuração é 1s2 2s2 2p6.
Já o potássio, na forma K+, fica com apenas 18 elétrons. Assim, sua configuração é 1s2 2s2 2p6 3s2 3p6.
Resposta Questão 4
Letra D.
A questão cita que se trata de um cátion trivalente, logo é uma espécie que perdeu 3 elétrons. Caso esses três elétrons sejam recolocados, retornando ao estado fundamental, perceberemos que a distribuição ficará da seguinte forma:
|
[Ar] |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑ |
↑ |
|
|
4s |
3d |
4p |
|||||||
Ou seja, o átomo, no estado fundamental, possui configuração [Ar] 4s2 3d10 4p2, totalizando 32 elétrons e, consequentemente, 32 prótons. A espécie que possui tal configuração é o germânio.
Resposta Questão 5
Letra B.
Pela distribuição em camadas do neônio, percebe-se que tal elemento possui 10 elétrons. Terão a mesma distribuição eletrônica que ele as espécies que forem isoeletrônicas (mesmo número de elétrons) a ele.
- Cl−: possui 18 elétrons, não é isoeletrônico.
- F−: possui 10 elétrons, é isoeletrônico.
- Mg2+: possui 10 elétrons, é isoeletrônico.
- Ca2+: possui 18 elétrons, não é isoeletrônico.
- Sr2+: possui 36 elétrons, não é isoeletrônico.
Resposta Questão 6
Letra C.
Todos os elementos do bloco d, como os citados no texto, possuem, na sua forma neutra, distribuição eletrônica terminando em ns2 (n−1)dx, em que “n” é o período e “x” é o número de elétrons do subnível de maior energia. Dessa forma, esses elementos, ao perderem dois elétrons, perdem o subnível “ns2”, pois este é um subnível de uma camada mais externa.
Assim sendo, a distribuição eletrônica do referido cátion quando este era um átomo neutro (antes de perder os dois elétrons) seria: 1s2 2s2 2p6 3s2 3p6 4s2 3d5. Logo, é possível perceber que, quando neutro (número de prótons igual ao de elétrons), esse elemento tinha 25 elétrons e, por conseguinte, 25 prótons. Com isso, é possível concluir que se trata do elemento manganês, Mn, pois este tem número atômico igual a 25.
Resposta Questão 7
Letra A.
O íon sódio, Na+, apresenta a seguinte distribuição eletrônica: 1s2 2s2 2p6. Assim, o último elétron é o sexto do subnível 2p. Nesse caso, como está no segundo nível, n = 2. Como é no subnível p, então l = 1 (pois, l = n – 1). Para o número quântico magnético (ml) e spin, vemos na imagem a seguir o porquê de o ml ser igual a +1 e o spin deste último elétron ser igual a +1/2.
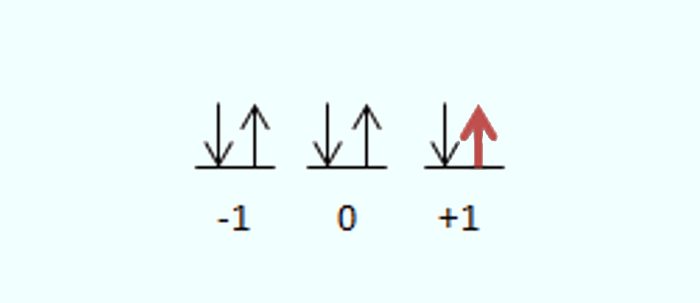
Resposta Questão 8
Letra B.
Pela configuração apresentada, o elétron mais energético pertence ao subnível d, mais especificamente d6. Como o elemento pertence ao quarto período, seu subnível de maior energia é 3d6, visto que esses elementos terminam a distribuição eletrônica em ns2 (n−1)dx, em que “n” é o número do período e “x” é o número de elétrons. Assim sendo, se n = 4, tal elemento termina a configuração em 4s2 3d6. O elemento descrito, então, possui configuração 1s2 2s2 2p6 3s2 3p6 4s2 3d6, totalizando 26 elétrons e, por conseguinte, 26 prótons. O elemento que possui número atômico igual a 26 é o ferro.
Resposta Questão 9
Letra B.
O magnésio, na forma Mg2+, possui 10 elétrons, cuja distribuição é 1s2 2s2 2p6. Assim sendo, seu elétron de maior energia se encontra no nível n = 2, que corresponde à camada L.
Resposta Questão 10
Letra B.
O número quântico principal para esse elemento é igual a 3, pois sua camada de valência se encontra no terceiro período. O número quântico secundário é igual a n−1 e, por conta disso, é igual a 2.
Resposta Questão 11
Letra A.
Se os átomos estão no estado fundamental, então são eletricamente neutros, ou seja, possuem o mesmo número de elétrons e prótons. O número de prótons será usado para identificar os elementos.
- O átomo I possui 13 elétrons; logo, 13 prótons, então se trata do alumínio.
- O átomo II possui 8 elétrons; logo, 8 prótons, então se trata do oxigênio.
- O átomo III possui 33 elétrons; logo, 33 prótons, então se trata do arsênio.
- O elemento IV possui 3 elétrons; logo, 3 prótons, então se trata do lítio.
Resposta Questão 12
Letra C.
A distribuição eletrônica do cádmio é [Kr] 5s2 4d10. Assim sendo, o subnível de valência (o que está em uma camada mais externa) é o 5s.