Questão 1
O benzeno (C6H6) é um composto orgânico líquido altamente tóxico que apresenta alta capacidade de desenvolver câncer. Ele pode ser obtido industrialmente e servir de matéria-prima para uma série de compostos orgânicos. A equação abaixo representa uma das reações de obtenção do benzeno:
6 C(s) + 3 H2(g) → C6H6(l)
Determine a variação da entropia da reação de formação do benzeno a partir do conhecimento da entropia de seus participantes: (Dados: SC= - 1,4 cal•K–1mol–1 ; SH2= -34,6 cal•K–1mol–1; SC6H6= -173,2 cal•K–1mol–1).
a) – 100 cal•K–1mol–1
b) – 61 cal•K–1mol–1
c) – 41 cal•K–1mol–1
d) – 54 cal•K–1mol–1
e) – 71 cal•K–1mol–1
Questão 2
A reação de formação do carbeto de cálcio, esquematizada abaixo, apresenta uma variação de entropia de 50 cal•K–1mol–1:
CaO(s) + 3C(s) → CaC2(s) + CO(g)
Marque a alternativa que apresenta o valor da entropia do óxido de cálcio, tendo como base a entropia de alguns participantes proposta na tabela:
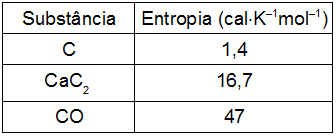
a) 10,5 cal•K–1mol–1
b) 8,5 cal•K–1mol–1
c) 9,5 cal•K–1mol–1
d) 6,5 cal•K–1mol–1
e) 5,5 cal•K–1mol–1
Questão 3
Uma das formas de produzir o óxido de cálcio (CaO) é a partir da decomposição do Carbonato de Cálcio por intermédio de aquecimento. Além do óxido de cálcio, a reação também produz gás carbônico. Veja a equação:
CaCO3 → CaO + CO2
A partir dos valores das entalpias e entropias de cada um dos participantes do processo, podemos afirmar que o processo possui a tendência de ser:
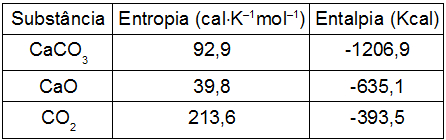
a) isobárico
b) adiabático
c) não espontâneo
d) espontâneo
e) nda.
Questão 4
Dada a equação de formação do ácido iodídrico:
H2(g) + I2(g) → 2 HI(g) a 25 °C,
Sabendo que, a 25 oC, as entropias-padrão dos participantes são, respectivamente, H2(g): 31,2 cal/K . mol; I2(g): 27,9 cal/K . mol; HI(g): 49,3 cal/K . mol, calcule a variação de entropia (ΔS) da reação e descubra se o valor encontrado indica se ela tende a ser espontânea.
a) 39,5 – tende a ser espontânea
b) 49,5 – tende a ser espontânea
c) 59,5 – tende a ser espontânea
d) – 39,5 – não tende a ser espontânea
e) – 49,5 – não tende a ser espontânea
Resposta Questão 1
Letra b). Para determinar a variação da entropia do sistema, basta utilizar os valores fornecidos na fórmula da variação, lembrando que o coeficiente estequiométrico de cada um na equação deve multiplicar o valor da entropia:
ΔS = SP –SR
ΔS = (SC6H6) – [6.(SC) + 3.(SH2)]
ΔS = (-173,2) – [6.(1,4) + 3.( -34,6)]
ΔS = -173,2 – (- 8,4 – 103,8)
ΔS = -173,2 + 112,2
ΔS = - 61 cal•K–1mol–1
Resposta Questão 2
Letra c). Para determinar o valor da entropia do óxido de cálcio (um reagente), basta utilizar os valores fornecidos na equação da variação da entropia, lembrando que o coeficiente estequiométrico de cada um na equação deve multiplicar o valor da entropia:
ΔS = SP –SR
ΔS = (SCaC2 + SCO) – [SCaO + 3.(SC)
50 = (16,7 + 47) – [SCaO + 3.(1,4)]
50 = 63,7 - SCaO - 4,2
SCaO = 63,7 -4,2 – 50
SCaO = 9,5 cal•K–1mol–1
Resposta Questão 3
Letra c). Para avaliar a tendência, devemos calcular inicialmente a variação da entropia e da entalpia:
Para a variação da entropia, utilizamos a seguinte fórmula:
ΔS = SP –SR
ΔS = (SCaO + SCO2) – (SCaCO3)
ΔS = (39,8 + 213,6) – (92,9)
ΔS = 253,4 – 92,9
ΔS = 160,5 cal•K–1mol–1
Para a variação da entalpia, utilizamos a seguinte fórmula:
ΔH = HP –HR
ΔH = (HCaO + HCO2) – (HCaCO3)
ΔH = [-635,1 + (-393,5)] – (-1206,9)
ΔH = (-635,1 - 393,5) + 1206,9
ΔH = -1028,6 + 1206,9
ΔH = + 178,3 Kcal/mol
Avaliação:
Como a variação da entropia e a variação da entalpia são positivas, o sistema tende a não ser espontâneo.
Resposta Questão 4
Letra b). Para determinar a variação da entropia do sistema, basta utilizar os valores fornecidos na fórmula da variação, lembrando que o coeficiente estequiométrico de cada um na equação deve multiplicar o valor da entropia:
ΔS = SP –SR
ΔS = 2.(SHI) – (SH2 + SI2)
ΔS = 2 . (49,3) – (31,2 + 27,9)
ΔS = 98,6 – 59,1
ΔS = 39,5 cal•K–1mol–1,
Tende a ser espontâneo, pois é positivo.



