Questão 1
Considere a tabela a seguir, que contém os valores das concentrações dos reagentes A e B de uma reação genérica realizada cinco vezes:
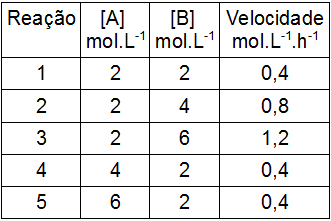
Com base nos valores da velocidade de cada um dos experimentos realizados, qual das alternativas a seguir apresenta a expressão da velocidade para essa reação?
a) v = k.[A].[B]
b) v = k.[A]
c) v = k.[A].[B]2
d) v = k.[B]
e) v = k.[B]2
Questão 2
Considere a reação a seguir com três reagentes (A, B, C):
A + B + C → D + E
Ela foi realizada em quatro experimentos. A tabela a seguir apresenta as concentrações iniciais dos reagentes e o tempo (em segundos) para a formação de uma mesma concentração do produto D:
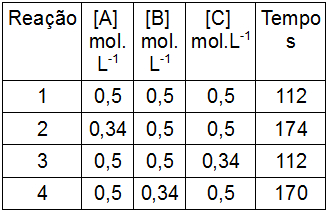
Por meio da análise dos dados fornecidos, podemos afirmar que a velocidade dessa reação é impactada por qual reagente?
a) A e B
b) A e C
c) A
d) C
e) B
Questão 3
(ESCS-DF) Considere as seguintes experiências que ocorrem com a reação:
2 H2(g) + 2 NO(g) → N2(g) + 2 H2O(g):
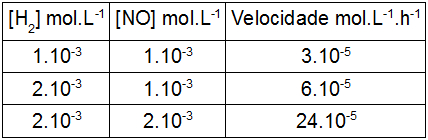
A partir dos dados experimentais, conclui-se que, de acordo com as ordens dos reagentes H2 e NO, é a seguinte a expressão da velocidade de reação, em função das concentrações, mol.L–1, dos reagentes:
a) v = k.[H2].[NO]2
b) v = k.[H2]2.[NO]2
c) v = k.[H2]2 .[NO]
d) v = k.[H2]2 .[NO]4
e) v = k.2[H2].4[NO]
Questão 4
(Furg) A cinética da reação:
2 A + 2 B → C
foi estudada sendo determinada a velocidade inicial da produção de C para misturas de várias composições, como está indicado na tabela abaixo, a 25°C.
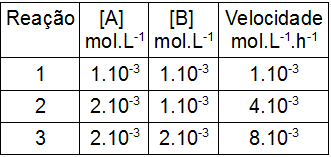
Se a lei de velocidade é dada por v = k[A]a.[B]b, então, os valores dos coeficientes “a” e “b” são, respectivamente:
a) 2 e 1.
b) 1 e 1.
c) 2 e 2.
d) -1 e 1.
e) -1 e 2.
Resposta Questão 1
Letra d). Para determinar a expressão da velocidade, devemos inicialmente determinar a ordem de cada um dos participantes escolhendo duas reações em que a concentração de um modifica-se e a do outro participante não.
-
Para o participante A:
Nas reações 1 e 4, a concentração dobra (de 2 para 4), e a velocidade (0,4 para 0,4) não se altera. Por essa razão, temos que a mudança na concentração do participante não afeta a velocidade da reação, logo, o participante B é de ordem nula.
[A] = velocidade
2 = 0
Ordem 0
-
Para o participante B, foram escolhidas as reações 1 e 2.
Nas reações 1 e 2, a concentração dobra (de 2 para 4), e a velocidade (0,2 para 0,4) também. Por essa razão, a proporção entre a concentração e a velocidade é de 1:1, logo, o participante B é de primeira ordem.
[B] = velocidade
2 = 2
Ordem 1
Por fim, montamos a expressão da velocidade por meio da multiplicação entre a concentração de A, elevada à sua ordem (0), e a concentração do participante B (1).
v = k.[A]0.[B]1
v = k.[B]
Resposta Questão 2
Letra a). Para determinar os reagentes que influenciam a velocidade da reação, devemos analisar a variação da concentração em relação à variação do tempo. Para isso, devemos escolher duas reações em que a concentração de um modifica-se e a do outro participante não.
-
Para o participante A, foram escolhidas as reações 1 e 3.
Nas reações 1 e 3, durante uma mesma unidade de tempo, houve uma variação de 0,5 para 0,74 na concentração do participante. Isso nos leva a crer que sua concentração modifica-se independentemente da mudança no tempo, não influenciando, assim, a velocidade.
-
Para o participante B, foram escolhidas as reações 1 e 4.
Nas reações 1 e 4, durante a variação do tempo (de 112 a 170), houve também uma variação de 0,5 para 0,74 na concentração do participante.
-
Para o participante C, foram escolhidas as reações 1 e 4.
Nas reações 1 e 4, durante a variação do tempo (de 112 a 170), houve também uma variação (de 0,5 para 0,74) na concentração do participante. Isso nos leva a crer que sua concentração modifica-se independentemente da mudança no tempo, não influenciando a velocidade.
Resposta Questão 3
Letra a). Para determinar a expressão da velocidade, devemos determinar a ordem de cada um dos participantes escolhendo duas reações em que a concentração de um modifica-se e a do outro participante não.
-
Para o participante H2, foram escolhidas as reações 1 e 2.
Nas reações 1 e 2, a concentração dobra (1.10-3 para 2.10-3), e a velocidade (3.10-5 para 6.10-5) também. Por essa razão, a proporção entre a concentração e a velocidade é de 1:1, logo, o participante B é de primeira ordem.
[H2] = velocidade
2 = 2
Ordem 1
-
Para o participante NO, foram escolhidas as reações 2 e 3.
Nas reações 2 e 3, a concentração dobra (1.10-3 para 2.10-3), e a velocidade (6.10-5 para 24.10-5) quadruplica. Por essa razão, a proporção entre a concentração e a velocidade é de 2:4, logo, o participante B é de segunda ordem.
[NO] = velocidade
2 = 4
2 = 22
Ordem 2
Por fim, montamos a expressão da velocidade por meio da multiplicação entre a concentração de H2, elevada à sua ordem (1), a a concentração do participante NO (2).
v = k.[H2]1.[NO]2
Resposta Questão 4
Letra a). Os valores de a e b são da ordem desses participantes na reação. Para determinar esses valores, é necessário escolher duas reações em que a concentração de um modifica-se e a do outro participante não.
-
Para o participante A, foram escolhidas as reações 1 e 2.
Nas reações 1 e 2, a concentração dobra (1.10-3 para 2.10-3), e a velocidade (1.10-3 para 4.10-3) quadruplica. Por essa razão, a proporção entre a concentração e a velocidade é de 2:4, logo, o participante A é de segunda ordem.
[B] = velocidade
2 = 4
2 = 22
Ordem 2
-
Para o participante B, foram escolhidas as reações 2 e 3.
Nas reações 2 e 3, a concentração dobra (1.10-3 para 2.10-3), e a velocidade (4.10-3 para 8.10-3) também. Por essa razão, a proporção entre a concentração e a velocidade é de 1:1, logo, o participante B é de primeira ordem.
[B] = velocidade
2 = 2
Ordem 1



