Questão 1
(UFMG) Dois recipientes contêm a mesma quantidade de H2SO4. No sistema I, coloca-se uma mola de ferro comprimida, no sistema II, outra mola, idêntica à primeira, mas não comprimida. Ambas são corroídas pelo ácido. Sobre esses sistemas, a afirmativa CORRETA é:
a) O sistema I, no estado final, terá mais ligações químicas do que o sistema II.
b) As espécies químicas do sistema I ficam mais aglomeradas do que as do sistema II.
c) A temperatura final do sistema I é mais alta do que a do sistema II.
d) O rendimento da reação do sistema I é mais alto do que o do sistema II.
e) A concentração final da solução do sistema I é maior do que a do sistema II.
Questão 2
Um químico realizou em laboratório alguns experimentos com o intuito de observar a velocidade em que uma solução aquosa do ácido HBr reagia com o magnésio metálico. Para isso, foram contadas, durante 20 segundos, as bolhas referentes à produção de gás hidrogênio logo após os reagentes serem misturados.
Na execução dos experimentos, foi utilizado o mesmo material metálico (magnésio), o mesmo volume de uma solução de HBr e a mesma massa do metal magnésio. Os critérios que sofreram alteração ao longo do experimento foram a forma de apresentação do magnésio (barra ou pedaços pequenos) e a temperatura. A tabela abaixo indica todas as condições utilizadas em cada experimento:

Assinale a alternativa que apresenta os experimentos na ordem crescente do número de bolhas observado.
a) B, A, C
b) C, B, A
c) A, B, C
d) B, C, A
e) nda.
Questão 3
A sabedoria popular indica que, para cozinhar batatas, é indicado cortá-las em pedaços. Em condições reacionais idênticas e utilizando massas iguais de batata, mas algumas inteiras e outras cortadas, verifica-se que a cortada cozinha em maior velocidade. O fator determinante para essa maior velocidade da reação é o aumento da:
a) pressão
b) temperatura
c) concentração
d) superfície de contato
e) natureza dos reagentes
Questão 4
(ACAFE-SC) O conhecimento da velocidade das reações químicas é de extrema importância para a produção industrial de uma série de produtos. Analise as afirmações a seguir.
I. A velocidade de uma reação química geralmente cresce com o aumento da temperatura.
II. A velocidade de uma reação química sempre independe da concentração dos reagentes.
III. A velocidade de uma reação química depende da orientação apropriada das moléculas na hora do choque.
IV. Para os sólidos, quanto maior a superfície de contato, menor será a velocidade da reação química.
Assinale a alternativa que indica somente as afirmações corretas.
a) II - III
b) I - IV
c) II - IV
d) I - II
e) I - III
Questão 5
O mel contém uma mistura complexa de carboidratos, enzimas, aminoácidos, ácidos orgânicos, minerais etc. O teor de carboidratos é de cerca de 70% da sua massa, sendo a glicose e a frutose os açúcares em maior proporção. A sua acidez é atribuída à ação da enzima glucose oxidase, que transforma a glicose em ácido glucônico e H2O2.
Abaixo temos a equação química de decomposição do peróxido de hidrogênio, na qual temos a formação de água líquida e oxigênio gasoso. Utilizando os dados da tabela fornecida, calcule a velocidade média de decomposição do peróxido de hidrogênio entre 0 e 10 minutos.
H2O2(aq) → H2O(l) + 1/2 O2(g)
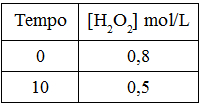
a) 2.10-4 mol.L–1.s–1
b) 3.10-4 mol.L–1.s–1
c) 4.10-4 mol.L–1.s–1
d) 5.10-4 mol.L–1.s–1
e) 3.10-2 mol.L–1.s–1
Questão 6
(Unimontes) Considere a reação a seguir:
C4H9Cl(aq) + H2O(l) → C4H9OH(aq) + HCl(aq)
Em um laboratório, a concentração de cloreto de butila foi medida conforme a reação se processava, como apresentado na tabela:
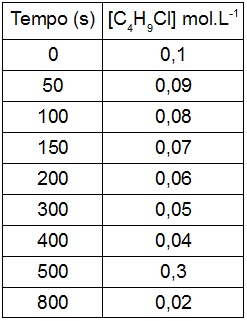
À medida que a reação se processa, pode-se afirmar que a taxa ou a velocidade média dessa reação:
a) aumenta.
b) não se altera.
c) duplica.
d) diminui.
e) nda.
Resposta Questão 1
Letra c). A temperatura final do sistema I é maior porque a reação de simples troca entre o ácido e o ferro é exotérmica e processa-se com maior velocidade, não havendo grande dissipação de calor. Já a II é uma reação lenta, e o calor vai sendo dissipado à medida que é liberado pela reação. As outras alternativas estão incorretas porque:
a) Como as quantidades de reagentes são as mesmas, logo, a quantidade de produtos será a mesma e, por isso, o número de ligações não será diferente.
b) O sistema I apresenta uma reação química mais veloz, logo, as moléculas chocam-se com maior intensidade e velocidade, não havendo, assim, aglomeração.
d) A quantidade de ácido utilizada em ambos é a mesma, e as molas são idênticas, logo, o rendimento é o mesmo.
e) A quantidade de ácido utilizada em ambos é a mesma, e as molas são idênticas, logo, a concentração é a mesma.
Resposta Questão 2
Letra a). Quanto maior a superfície de contato (pedaços menores) e maior a temperatura, maior será a velocidade de uma reação. Assim, a ordem correta é a da letra a) porque:
Experimento B = Barra possui menor superfície de contato e 30 ºC é uma temperatura baixa em comparação com as outras; logo, a reação é mais lenta e produz menos bolhas.
Experimento A = Barra possui maior superfície de contato e 50 ºC é uma temperatura alta em comparação com as outras. A reação é mais lenta que a do experimento C e mais rápida em relação ao experimento A, com uma menor produção de bolhas que C e mais bolhas que B.
Experimento C = Pedaços pequenos possuem menor superfície de contato e 50 ºC é uma temperatura alta em comparação com as outras, logo, a reação é mais rápida e possui maior produção de bolhas.
Resposta Questão 3
Letra d). A resposta é a letra d) porque, quando cortamos uma batata em pedaços menores e colocamos para cozinhar, estamos fazendo com que a ação do calor seja realizada em uma área maior, isto é, estamos aumentando a superfície de contato.
Resposta Questão 4
Letra e). A resposta é a letra e) porque os itens abaixo estão incorretos porque:
II- Quanto maior a concentração dos reagentes, maior será a velocidade da reação e vice-versa, ou seja, a concentração tem grande influência na velocidade.
IV- Sempre que a superfície de contato for maior, a velocidade da reação também será.
Resposta Questão 5
Letra d) Para realizar o cálculo da velocidade de composição do peróxido de hidrogênio, é necessário inicialmente converter o tempo que está em minutos para segundos multiplicando por 60:
10 minutos . 60 = 600 segundos.
Em seguida, basta utilizar a fórmula que relaciona a variação da concentração com a variação do tempo:
v = Δ[]
Δt
v = 0,5 – 0,8
600-0
v = -0,3
600
v = |-5.10-4| mol.L–1.s–1
Resposta Questão 6
Letra d). A melhor forma de comprovar que a velocidade de uma reação está diminuindo ou aumentando é por meio do cálculo da velocidade em intervalos de tempo diferentes. No caso da reação, percebemos que a diminuição da velocidade é:
Entre 0 e 150 segundos:
v = 0,07 – 0,1000
150-0
v = -0,03
150-0
v = 2.10-4 mol.L–1.s–1
Entre 300 e 800 segundos:
v = 0,02 – 0,05
800-300
v = -0,03
500
v = 6. 10-5 mol.L–1.s–1



