Questão 1
(UEG) A atmosfera é uma camada gasosa que possui função essencial para a manutenção da vida na Terra, sendo uma mistura gasosa composta de vários tipos de moléculas de origem natural e antrópica, como o CH3, O3, N2 e SO3. As moléculas apresentadas, respectivamente, apresentam as seguintes geometrias moleculares:
a) Tetraédrica, Trigonal, Linear, Trigonal.
b) Trigonal, Angular, Angular, Tetraédrica.
c) Trigonal, Linear, Tetraédrica, Angular.
d) Tetraédrica, Angular, Linear, Trigonal.
Questão 2
(FATEC-SP) A geometria molecular descreve a maneira como os núcleos atômicos que constituem uma molécula estão posicionados uns em relação aos outros. Assim, numere a coluna B, que contém certas substâncias químicas, associando-as com a coluna A, de acordo com o tipo de geometria molecular que cada substância apresenta.
Coluna A
1. Angular
2. Piramidal
3. Tetraédrica
4. Trigonal Plana
Coluna B
( ) SO2
( ) CH2O
( ) PF3
( ) SiH4
Dados: H (Z=1); C (Z=6); O (Z=8); F (Z=9); Si (Z=14); P (Z=15) e S (Z=16).
A sequência correta dos números da coluna B, de cima para baixo, é
a) 1 - 4 - 3 - 2.
b) 2 - 1 - 4 - 3.
c) 1 - 2 - 4 - 3.
d) 3 - 4 - 1 - 2.
e) 1 - 4 - 2 - 3.
Questão 3
A poluição atmosférica ocorre pela liberação de diversos gases a partir de veículos, atividades industriais e também da pecuária. Entre os gases que promovem a poluição, destacam-se CO2, CO, SO2 e CH4, que possuem peso molecular considerado elevado. A molécula que apresenta geometria angular é:
a) CO2
b) SO2
c) CO
d) CH4
Questão 4
Associe a coluna da esquerda com a coluna da direita relacionando a espécie química com a sua respectiva geometria. Depois, marque a sequência correta de cima para baixo:
I. HCN ( ) Piramidal
II. SF6 ( ) Linear
III. NH3 ( ) Angular
IV. BF3 ( ) Trigonal planar
V. SO2 ( ) Octaédrica
a) II, V, III, I, IV.
b) III, I, V, IV, II.
c) II, III, V, I, IV.
d) IV, III, V, I, II.
e) IV, V, III, II, I.
Resposta Questão 1
Letra d).
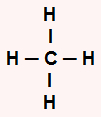
CH4: apresenta geometria tetraédrica porque é uma molécula pentatômica, havendo quatro átomos de hidrogênio ligados ao Carbono e nenhum par de elétrons livres no átomo central. O carbono apresenta quatro elétrons na camada de valência e utiliza-os nas ligações com os hidrogênios.
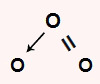
O3: apresenta geometria angular porque é uma molécula triatômica que possui um par de elétrons não ligantes no átomo central. O oxigênio central apresenta seis elétrons na camada de valência e utiliza dois na ligação dupla e outros dois na ligação dativa, sobrando um par.
N2: como é uma molécula diatômica, apresenta geometria linear.
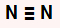
SO3: apresenta geometria trigonal por ser uma molécula tetratômica sem par de elétrons no átomo central. O enxofre central apresenta seis elétrons na camada de valência e utiliza dois na ligação dupla e outros dois em cada uma das duas dativas, não sobrando elétron não ligante.
Resposta Questão 2
Letra e). As geometrias aplicadas à cada molécula, segundo a resposta, devem-se à seguinte avaliação:
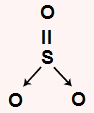
SO2: apresenta geometria angular por ser uma molécula triatômica que possui um par de elétrons não ligantes no átomo central. O enxofre central apresenta seis elétrons na camada de valência e utiliza dois na ligação dupla e outros dois na dativa, sobrando, assim, um par.
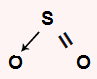
CH2O: apresenta geometria trigonal por ser uma molécula tetratômica sem par de elétrons no átomo central. O carbono central apresenta quatro elétrons na camada de valência e utiliza dois na ligação dupla e outros dois em cada uma das duas simples, não sobrando elétron não ligante.
PF3: apresenta geometria piramidal por ser uma molécula tetratômica que possui um par de elétrons não ligantes no átomo central. O fósforo central apresenta cinco elétrons na camada de valência e utiliza três nas ligações simples, sobrando, assim, um par.
SiH4: apresenta geometria tetraédrica por ser uma molécula pentatômica, havendo quatro átomos de hidrogênio ligados ao silício e nenhum par de elétrons livres no átomo central. O silício apresenta quatro elétrons na camada de valência e utiliza-os nas ligações com os hidrogênios.
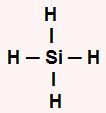
Resposta Questão 3
Letra b). As outras alternativas estão incorretas porque:
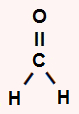
a) apresenta geometria linear por ser uma molécula triatômica que não possui par de elétrons não ligantes no átomo central. O carbono central apresenta quatro elétrons na camada de valência e utiliza-os nas duas ligações duplas, não sobrando elétron não ligante.

c) como é uma molécula diatômica, sempre apresenta geometria linear.
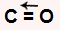
d) apresenta geometria tetraédrica por ser uma molécula pentatômica, havendo quatro átomos de hidrogênio ligados ao Carbono e nenhum par de elétrons livres no átomo central. O carbono apresenta quatro elétrons na camada de valência e utiliza-os nas ligações com os hidrogênios.
.jpg)
Resposta Questão 4
Letra b). As geometrias aplicadas à cada molécula, segundo a resposta, devem-se à seguinte avaliação:
SO2: apresenta geometria angular por ser uma molécula triatômica que possui um par de elétrons não ligantes no átomo central. O enxofre central apresenta seis elétrons na camada de valência e utiliza dois na ligação dupla e outros dois na dativa, sobrando, assim, um par.
.jpg)
NH3: apresenta geometria piramidal por ser uma molécula tetratômica que possui um par de elétrons não ligantes no átomo central. O nitrogênio central apresenta cinco elétrons na camada de valência e utiliza três nas ligações simples, sobrando, assim, um par.
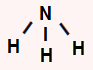
HCN: apresenta geometria linear por ser uma molécula triatômica que não possui um par de elétrons não ligantes no átomo central. O carbono central apresenta quatro elétrons na camada de valência e utiliza-os nas ligações simples e na tripla, não sobrando, assim, elétron não ligante.
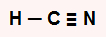
BF3: apresenta geometria trigonal por ser uma molécula tetratômica sem um par de elétrons no átomo central. O boro central apresenta três elétrons na camada de valência e utiliza todos eles nas três ligações simples, não sobrando elétron não ligante.
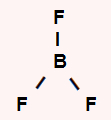
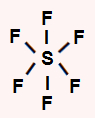
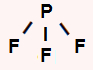
SF6: apresenta geometria octaédrica por ser uma molécula heptatômica. O enxofre central apresenta seis elétrons na camada de valência e utiliza todos eles nas seis ligações simples, não sobrando elétron não ligante.