Questão 1
Considere a situação de equilíbrio abaixo:
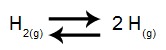
Temos acima um processo endotérmico que representa a quebra da ligação covalente entre os dois átomos de hidrogênio. Assim, qual será a variação na constante de equilíbrio K para a reação de acordo com os seguintes critérios:
I- a temperatura (T) é elevada;
II- o volume (V) do sistema diminui
I- T aumenta II- V diminui
a) K diminui K diminui
b) K diminui K aumenta
c) K não se modifica K não se modifica
d) K não se modifica K aumenta
e) K aumenta K não se modifica
Questão 2
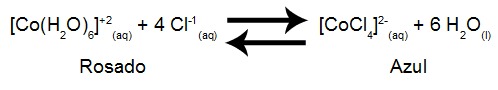
A equação abaixo representa o equilíbrio químico obtido pela mistura de uma solução de cloreto de cobalto II com outra solução de ácido clorídrico:
Em um experimento, a solução foi dividida em três partes, que, por sua vez, foram adicionadas a tubos de ensaio diferentes. Cada um dos três tubos de ensaio foi submetido a uma temperatura diferente, sob pressão ambiente, como podemos observar na ilustração abaixo:
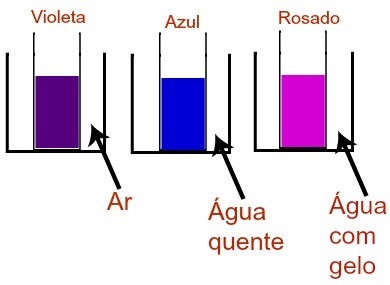
Comparando a equação e a ilustração, assinale o que for correto:
a) O aumento da temperatura desloca o equilíbrio para a direita.
b) O aumento da temperatura desloca o equilíbrio para a esquerda.
c) O aumento da temperatura promove a ocorrência da coloração violeta no experimento.
d) A diminuição da temperatura desloca o equilíbrio para a direita.
e) nda.
Questão 3
(FATEC-SP) Uma das etapas do processo de produção do ácido sulfúrico é a obtenção de SO3 a partir do SO2,
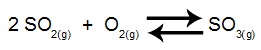
A tabela a seguir mostra a porcentagem de SO3 no equilíbrio, a várias temperaturas:
.jpg)
Três afirmações foram feitas a respeito desse equilíbrio:
I. As espécies que coexistem quando o equilíbrio é alcançado são: SO2 ,SO3 e O2.
II. A reação de formação do SO3 é exotérmica.
III. Nessa etapa do processo, o fabricante deve utilizar temperaturas entre 600 oC e 800 oC.
Sobre tais afirmações, os dados permitem concluir que:
a) apenas I está correta.
b) apenas III está correta.
c) apenas I e II estão corretas.
d) apenas I e III estão corretas.
e) as três estão corretas.
Questão 4
(INTEGRADO-RJ) Abaixo é apresentada uma reação química em equilíbrio:
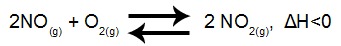
Com o objetivo de deslocar esse equilíbrio no sentido da formação de dióxido de nitrogênio, deve-se:
a) diminuir a pressão e a temperatura
b) aumentar a pressão e a temperatura
c) aumentar a pressão e diminuir a temperatura
d) aumentar a pressão e diminuir as concentrações de NO e O2
e) aumentar a temperatura e as concentrações de NO e O2
Resposta Questão 1
Letra e). O enunciado informa que o equilíbrio é endotérmico, logo, a reação direta é endotérmica e a inversa é exotérmica. A constante do equilíbrio é dada pela seguinte expressão:
K = [H]2
H2
Conhecendo as características das reações (direta e inversa) e a expressão, quando a temperatura é aumentada (como informa o item I do enunciado), ela sempre desloca o equilíbrio no sentido da reação endotérmica (para a direita). Nesse exercício, teremos então o aumento da quantidade de H, que é o denominador, e, consequentemente, o aumento do valor de K.
Resposta Questão 2
Letra a). O equilíbrio químico fornecido apresenta coloração rosada em seu lado esquerdo e azul em seu lado direito. Quando analisamos a ilustração, vemos que a cor azul está no tubo de ensaio que foi aquecido, logo, devemos interpretar que o aumento da temperatura desloca o equilíbrio para o seu lado direito, que é o azul.
Resposta Questão 3
Letra c). A alternativa “c” está correta porque:
I- Verdadeiro. De acordo com a equação, as espécies que coexistem no equilíbrio são SO2 ,SO3 e O2.
II- Verdadeiro. De acordo com a tabela, quanto menor a temperatura, maior a porcentagem de SO3.
III- Na etapa foram utilizadas temperaturas entre 500 oC e 400 oC porque é nessa faixa que se produz mais SO3.
Resposta Questão 4
Letra c). Como o ΔH da reação é menor que zero, a reação direta é exotérmica e a inversa é endotérmica. Assim, como se deseja aumentar a formação do NO2, que está à direita, devemos deslocar o equilíbrio para o seu lado, o que é conseguido de acordo com as seguintes hipóteses:
-
diminuindo a temperatura;
-
aumentando as concentrações de NO ou O2 (como eles estão à esquerda, aumentando-os, deslocamos o equilíbrio para a direita);
-
Aumentando a pressão, pois deslocamos para o lado de menor volume (que é o da direita por ter apenas 2 mols ou 2 volumes).



