Questão 1
(Unemat)

Sabendo-se, então, que o coeficiente de solubilidade do K2Cr2O7 é de 12,0 gramas em 100 mL de água à T=20º C, que tipo de sistema será formado quando forem adicionadas 120 gramas de K2Cr2O7 em 600 mL de água à T=20º C?
A) Um sistema heterogêneo, com 48 gramas de K2Cr2O7 como precipitado (corpo de fundo).
B) Um sistema homogêneo, com 48 gramas de K2Cr2O7 dissolvidas completamente.
C) Uma solução insaturada.
D) Um sistema heterogêneo, saturado, com volume final igual a 820 mL.
E) Um sistema homogêneo onde 120 gramas de K2Cr2O7 foram completamente dissolvidas.
Questão 2
(Fepese) Em uma determinada temperatura, realizou-se a preparação de uma solução aquosa saturada de sal resultando em uma quantidade significativa de sal precipitado. Dependendo de como essa solução heterogênea for armazenada, manipulada ou modificada, ela pode aumentar ou diminuir a quantidade de sal dissolvido e precipitado.
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) com base nessas informações.
( ) A adição de mais água na solução saturada favorecerá a solubilização do sal, o que acarretará a diminuição da massa do precipitado.
( ) Se uma quantidade de solução saturada for retirada, ocorrerá um aumento da massa do precipitado.
( ) O aumento da temperatura favorecerá a solubilização do sal, o que caracteriza um processo endotérmico.
( ) Se a solução permanecer aberta e exposta ao ar, ocorrerá diminuição da massa de sal precipitado.
( ) A dissolução do sal em um líquido é sempre um processo exotérmico.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
A) V, F, V, V, F.
B) V, F, V, F, F.
C) V, F, F, V, V.
D) F, V, V, V, F.
E) F, V, F, F, V.
Questão 3
(Uenp) Soluções moleculares e iônicas podem ser saturadas ou supersaturadas, dependendo da quantidade de soluto no solvente e da temperatura. Uma solução aquosa saturada de ureia sem corpo de fundo pesa 250 g. Se essa solução é aquecida até evaporar todo o solvente, obtém-se um resíduo de 30 g. Assinale a alternativa que apresenta, corretamente, a solubilidade da ureia em 100 g de água, na temperatura analisada.
A) 3,0
B) 7,3
C) 8,3
D) 13,6
E) 30,3
Questão 4
(Unespar) Numa aula de química experimental, o professor mostrou aos alunos que numa tabela específica sobre os principais coeficientes de solubilidade encontra-se o do Cloreto de Sódio (NaCl) e que a 15 °C solubilizam-se 380 g deste sal em 1 (um) litro de água. Uma equipe de alunos recebeu uma amostra de 20 g de uma solução saturada de NaCl. Com estas informações, determine a massa do resíduo que aparece ao se evaporar toda a água da amostra.
A) 5 g
B) 5,5 g
C) 50 g
D) 55 g
E) 0,5 g
Questão 5
O que caracteriza uma solução saturada?
A) Uma solução que contém mais soluto do que o solvente e que pode se dissolver naquela temperatura.
B) Uma solução em que o solvente já evaporou completamente.
C) Uma solução diluída, com baixa concentração de soluto.
D) Uma solução que contém apenas soluto dissolvido, sem corpo de fundo.
E) Uma solução em que há um equilíbrio entre soluto dissolvido e soluto precipitado.
Questão 6
Em um experimento, um estudante dissolve 30 g de sal (NaCl) em 100 g de água a 20 °C. Sabendo que o coeficiente de solubilidade do NaCl nessa temperatura é 36g/100 g de água, podemos classificar essa solução como:
A) insaturada
B) saturada
C) supersaturada
D) concentrada
E) diluída
Questão 7
O coeficiente de solubilidade de um soluto pode ser alterado pela:
A) adição de mais solvente.
B) agitação da solução.
C) variação da temperatura.
D) mudança na pressão atmosférica.
E) adição de outro soluto.
Questão 8
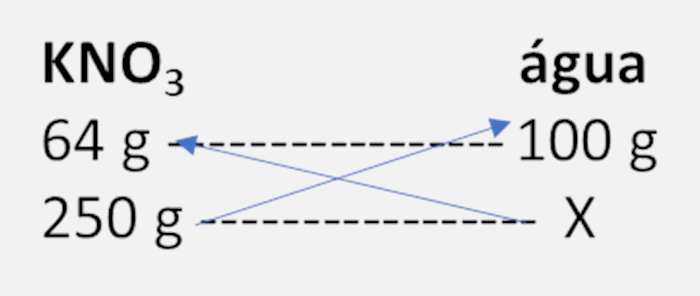
A solubilidade do KNO3 em água em 40 °C é de 64 g por 100 g de H2O. Nesse sentido, qual a massa desse sal é necessária para saturar 250 g de água?
A) 80 g
B) 120 g
C) 32 g
D) 160 g
Questão 9
Uma solução insaturada pode ser transformada em saturada pela:
A) adição de mais solvente.
B) redução da temperatura.
C) adição de mais soluto até atingir o coeficiente de solubilidade.
D) agitação constante da solução.
E) filtração do soluto não dissolvido.
Questão 10
Em uma solução saturada com corpo de fundo, é correto afirmar que:
A) O soluto restante não pode mais ser dissolvido.
B) A solução está supersaturada.
C) O solvente não é capaz de dissolver o soluto.
D) A temperatura do sistema é muito baixa.
E) A solução está insaturada.
Questão 11
Em 30 °C, a solubilidade do CuSO4 em água é de 30 g para cada 100 g de solvente. Durante uma aula de química, um estudante dissolve 90 g desse sal em 200 g de água, logo, a solução será:
A) insaturada
B) saturada
C) supersaturada
D) coloidal
E) imiscível
Questão 12
Uma solução supersaturada é obtida quando:
A) A quantidade de soluto dissolvido é menor que o coeficiente de solubilidade.
B) A quantidade de soluto dissolvido é igual ao coeficiente de solubilidade.
C) A quantidade de soluto dissolvido excede o coeficiente de solubilidade.
D) O soluto não se dissolve no solvente.
E) A temperatura do sistema é mantida constante.
Resposta Questão 1
Alternativa A.
Para manter a solubilidade em uma temperatura constante, o volume do solvente deve aumentar à medida que a quantidade de soluto dissolvida aumenta; logo, se o coeficiente de solubilidade é 12,0 gramas em 100 mL, para 600 mL a massa de soluto será definida por uma regra de três simples:
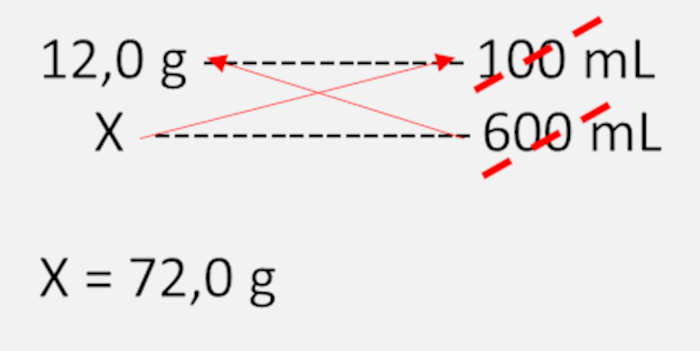
Nesse caso, se forem adicionados 120,0 g de soluto, teremos: 120 – 72 = 48,0 g, ou seja, 48,0 g de soluto acima do seu valor de solubilidade. Portanto, a solução será heterogênea com precipitado de K2Cr2O7.
Resposta Questão 2
Alternativa B.
Nesse caso vamos analisar cada alternativa:
A) Verdadeiro. Adicionar mais água aumenta a capacidade de dissolução do solvente, permitindo que mais sal se dissolva e reduzindo a massa do precipitado.
B) Falso. Retirar uma quantidade da solução saturada não altera a quantidade de precipitado, pois a solução já está saturada.
C) Verdadeiro. Para muitos sais, o aumento da temperatura aumenta a solubilidade, indicando que o processo de dissolução é endotérmico, ou seja, absorve calor.
D) Falso. Se a solução estiver exposta ao ar, a água pode evaporar, aumentando a concentração da solução e, consequentemente, a massa do precipitado, e não a diminuindo.
E) Falso. A dissolução do sal pode ser endotérmica ou exotérmica, dependendo do sal e do solvente.
Resposta Questão 3
Alternativa D.
Perceba que se a massa da solução é 250 g e a massa da ureia após a evaporação é de 30 g, isso significa que a massa do solvente era de 220 g (250 g – 30 g = 220 g). Dessa forma, tínhamos 30 g de ureia dissolvidos em 220 g de solvente. Portanto, a solubilidade da ureia é a quantidade que pode ser dissolvida em 100 g do solvente. Sendo assim, façamos uma regra de três:
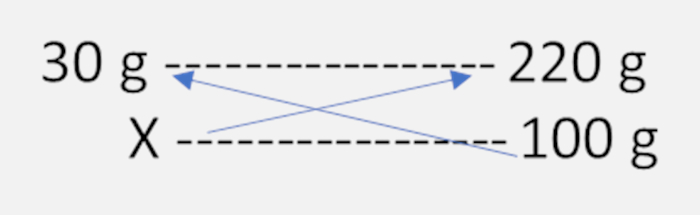
x = (30 x 100) / 220 x = 13,6 g
Resposta Questão 4
Alternativa B.
Primeiro encontramos a massa da solução: 380 g (sal) + 1000 g (água) = 1380 g de solução. A partir disso, podemos fazer uma relação entre massa da solução e massa do soluto para descobrir a massa do resíduo (sal) que restou após a evaporação:
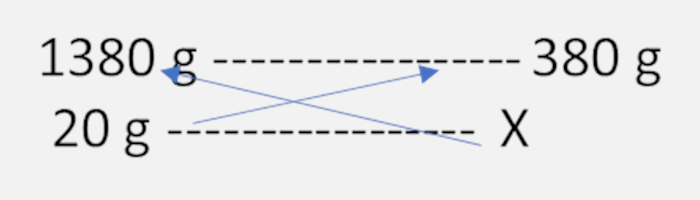
x = (20 x 380) / 1380 x = 5,5 g
Portanto, a massa de sal que havia na solução saturada de 20 g era 5,5 g.
Resposta Questão 5
Alternativa E.
Uma solução saturada é aquela que contém a quantidade máxima de soluto dissolvido em equilíbrio com o soluto não dissolvido, isto é, o corpo de fundo. Em outras palavras, qualquer adição extra de soluto levará à precipitação, pois a capacidade de dissolução já foi atingida.
Resposta Questão 6
Alternativa A.
A solução é insaturada porque a quantidade de 30 g do soluto é menor que o coeficiente de solubilidade (36 g), portanto, ainda é possível dissolver mais sal na água. As alternativas B e C estão incorretas porque não foram atingidos os limites de solubilidade. Já as alternativas D e E são termos relativos que não se aplicam diretamente ao conceito de saturação.
Resposta Questão 7
Alternativa C.
O coeficiente de solubilidade depende principalmente da temperatura e, no caso dos gases, da pressão. Sendo assim, nenhuma das outras alternativas é capaz de influenciar no coeficiente de solubilidade do soluto.
Resposta Questão 9
Alternativa C.
Uma solução insaturada é aquela cujo coeficiente de solubilidade não foi atingido. Portanto, para saturar uma solução desse tipo, é necessário adicionar soluto até atingir o limite de solubilidade.
Resposta Questão 10
Alternativa A.
Em uma solução saturada com corpo de fundo, a quantidade máxima de soluto já foi dissolvida, e o excesso permanece no fundo do recipiente.
Resposta Questão 11
Alternativa B.
Primeiro, calculamos a quantidade máxima de soluto que pode ser dissolvida em 200 g de água:
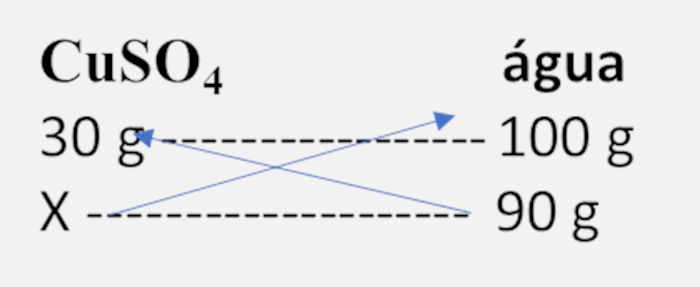
X = 60 g
Se a solução contém 90 g de CuSO4, e apenas 60 g se dissolvem, significa que 30 g precipitam, indicando uma solução saturada com corpo de fundo.
Resposta Questão 12
Alternativa C.
Uma solução supersaturada contém mais soluto do que o máximo que poderia ser dissolvido em condições normais, o que geralmente é alcançado por meio de aquecimento e resfriamento controlado.