Questão 1
Com relação aos átomos abaixo:
21X50 22Y50 21R49
Podemos afirmar que:
a) Y e R são isótopos.
b) X e R são isóbaros.
c) X e R são isótonos.
d) X e R possuem o mesmo número de elétrons.
e) X e Y deveriam estar representados pelo mesmo símbolo químico.
Questão 2
Considere as representações fornecidas para os átomos A, B e C:
3x+32A11x+15 5x-8B12x-2 4x+10C10x+35
Sabendo que os átomos A e C são isóbaros, assinale a alternativa que indica corretamente os números de massa dos átomos A, B e C.
a) 238, 238,238
b) 235, 235, 235
c) 235,235, 238
d) 235, 238, 235
e) 238, 235, 235
Questão 3
(IFSP) Considere a tabela a seguir, que fornece características de cinco átomos (I, II, III, IV e V).
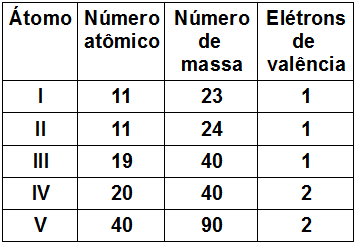
São isótopos entre si os átomos
a) I e I I.
b) I I. e III.
c) I, I I. e III.
d) III e IV.
e) IV e V.
Questão 4
(UCS) No organismo humano, alguns dos elementos químicos existem na forma de íons. Esses íons desempenham um papel fundamental em vários processos vitais, participando de reações químicas. Os íons 11Na+ e 12Mg2+, por exemplo, estão, respectivamente, envolvidos no equilíbrio eletrolítico e no funcionamento dos nervos. Em relação aos íons 23Na+ e 24Mg2+, é correto afirmar que são
a) isótopos e isoeletrônicos.
b) isoeletrônicos e isótonos.
c) isótonos e isóbaros.
d) isóbaros e isótopos.
e) isoeletrônicos e isóbaros.
Resposta Questão 1
Letra d). Os átomos X e R apresentam o mesmo número de elétrons (21). As outras alternativas estão incorretas porque:
a) Y e R não podem ser isótopos porque apresentam números atômicos diferentes.
b) X e R não podem ser isóbaros porque apresentam números de massa diferentes.
c) O átomo X apresenta 29 nêutrons (resultado da subtração entre a massa (50) e o número atômico (21)), e o átomo R apresenta 28 elétrons (resultado da subtração entre a massa (49) e o número atômico (21)), por isso, não são isótonos.
e) Os átomos, para serem representados pelo mesmo símbolo, devem apresentar o mesmo número atômico.
Resposta Questão 2
Letra d). Para encontrar os valores das massas de A, B e C, devemos igualar as massas de A e C (são isóbaros) para encontrar o valor de x, da seguinte forma:
11x + 15 = 10x + 35
11x – 10x = 35 – 15
x = 20
Após encontrar o valor de x, basta substituí-lo em cada uma das expressões para número de massa em que ele aparece:
Para o átomo A:
11x + 15
(11).20 + 15
220 + 15
235
Para o átomo B:
12x-2
(12).20 -2
240 -2
238
Para o átomo C:
10x+35
(10).20 +15
220+15
235
Resposta Questão 3
Letra a). Para serem isótopos, os átomos devem apresentar o mesmo número atômico ou o mesmo número de prótons, o que ocorre com os átomos I e II.
Resposta Questão 4
Letra b). O exercício fornece as seguintes informações sobre os cátions Na+ e Mg+2:
Para o Na+:
- Número atômico = 11
- Número de prótons = 11
- Número de elétrons = 10 (ele perde um elétron - carga +)
- Número de massa = 23
- Número de nêutrons = 12 (resultado da subtração da massa (23) pelo número atômico (11))
Para o Mg+2:
- Número atômico = 12
- Número de prótons = 12
- Número de elétrons = 10 (ele perde dois elétrons - carga +2)
- Número de massa = 24
- Número de nêutrons = 12 (resultado da subtração da massa (24) pelo número atômico (12))
Como os cátions apresentam o mesmo número de elétrons e o mesmo número de nêutrons, são classificados, respectivamente, em isoeletrônicos e isótonos.



