Questão 1
Um estudante de Química encontra no laboratório quatro frascos, contendo diferentes soluções e líquidos, que estavam etiquetados da seguinte forma:
- frasco 1: água destilada
- frasco 2: solução aquosa de MgBr2 0,4 mol/L
- frasco 3: solução aquosa de KBr 0,4 mol/L
- frasco 4: solução aquosa de sacarose 0,4 mol/L
Logo em seguida, seu professor pede para que ele coloque os frascos em ordem crescente de pressão máxima de vapor do solvente.
a) frasco 2 > frasco 3 > frasco 4 > frasco 1
b) frasco 1 > frasco 4 > frasco 3 > frasco 2
c) frasco 2 < frasco 3 < frasco 4 < frasco 1
d) frasco 1 < frasco 4 < frasco 3 < frasco 2
e) frasco 1 < frasco 3 < frasco 4 < frasco 2
Questão 2
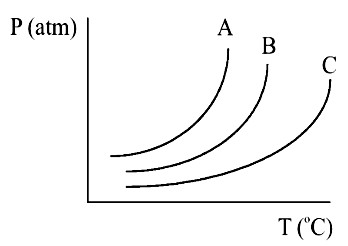
Considere os seguintes sistemas e o gráfico a seguir:
I. água pura;
II. solução aquosa 0,2 mol/L de NaCl;
III. solução aquosa 0,2 mol/L de glicose.
Após relacionar cada um dos sistemas às curvas do gráfico, é correto afirmar que:
a) o líquido mais volátil é representado pela curva C.
b) a curva A representa o sistema III.
c) a curva B representa o sistema III.
d) em uma mesma pressão, a ordem crescente de pressão de vapor é pvA< pvB < pvC.
e) a curva C representa o sistema I.
Questão 3
(PUC-MG) Sejam dadas as seguintes soluções aquosas:
I. 0,1 mol/L de glicose
II. 0,2 mol/L de sacarose
III. 0,1 mol/L de ácido clorídrico
IV. 0,2 mol/L de cloreto de potássio
V. 0,2 mol/L de sulfato de sódio
Das soluções acima, assinale a opção que apresenta menor pressão de vapor:
a) I
b) II
c) III
d) IV
e) V
Questão 4
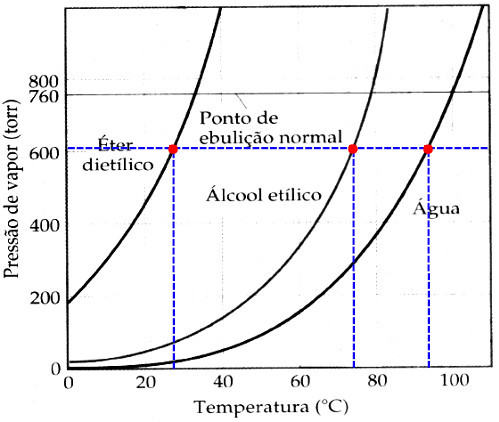
(Unimontes-MG) A pressão de vapor de três líquidos é mostrada em função da temperatura na figura abaixo:
Utilizando-se da figura, pode-se estimar o ponto de ebulição dessas substâncias. Sob uma pressão externa de 0,80 atm, é correto afirmar que
a) o álcool etílico e a água entrarão em ebulição a uma mesma temperatura.
b) a água entrará em ebulição a uma temperatura inferior à temperatura ambiente.
c) a água terá seu ponto de ebulição normal, se a pressão acima do líquido diminuir.
d) o éter dietílico entrará em ebulição a uma temperatura próxima à temperatura ambiente.
Resposta Questão 1
Letra c). Por regra geral, um solvente puro sempre apresenta maior pressão de vapor que as soluções em que ele está presente. Assim, nesse exercício, a água apresenta a maior pressão de vapor.
Para determinar a menor pressão de vapor entre as outras soluções, seguimos os critérios de maior concentração, maior número de partículas e maior grau de ionização. No exercício, todas apresentam a mesma concentração, e não foi fornecido o grau de ionização. Portanto, avaliaremos a quantidade de partículas:
- Solução de MgBr2: apresenta um soluto iônico, que libera 1 mol cátion Mg+2 e 2 mol ânions Br-.
- Solução de KBr: apresenta um soluto iônico, que libera 1mol cátion K+ e 1 mol ânion Br-.
- Solução de sacarose: apresenta um soluto molecular. Por essa razão, ao adicionar 1 mol do soluto, teremos da mesma forma um mol do soluto na solução.
Assim, das três acima, a solução de MgBr2 possui a menor pressão de vapor, e a maior é a de sacarose. Assim, a ordem crescente será:
frasco 2 < frasco 3 < frasco 4 < frasco 1
Resposta Questão 2
Letra c). A análise gráfica da pressão máxima de vapor de líquidos diferentes é bem simples. Quanto mais próxima do eixo y (à esquerda), maior a pressão de vapor. Da mesma forma, quanto mais distante, menor a pressão. Assim, temos:
- Curva A apresenta maior pressão de vapor, e é da água (sistema I), porque o solvente puro sempre apresenta maior pressão de vapor;
- Curva B apresenta pressão intermediária em relação às curvas A e B, e é a solução com glicose, pois é um soluto molecular;
- Curva C apresenta menor pressão de vapor, e é a solução com NaCl, pois é um soluto iônico.
Resposta Questão 3
Letra e). O exercício pede a solução de menor pressão de vapor, a qual deve apresentar sempre a maior concentração e um soluto iônico. Entre as opções fornecidas, temos três de maior concentração, sendo uma delas molecular (sacarose), a qual já está descartada.
Sobram, então, duas soluções, a de cloreto de potássio (KCl) e a de sulfato de sódio (Na2SO4):
- KCl: apresenta dois íons, 1 cátion K+ e um ânion Cl-;
- Na2SO4: apresenta três íons, 2 cátions Na+ e 1 ânion SO4-2.
Como as soluções acima apresentam a maior concentração, devemos escolher aquela que apresenta o maior número de partículas, que é a de Na2SO4.
Resposta Questão 4
Letra d). Inicialmente, é necessário converter a pressão 0,8 atm para a pressão torr. Para isso, basta multiplicar por 760, que resulta em 608 torr. Em seguida, demarcamos essa pressão no gráfico fornecido, marcando os pontos nas curvas:
a- Analisando o gráfico, verificamos que cada líquido apresenta um ponto de ebulição diferente.
b- Analisando o gráfico, sabemos que o ponto de ebulição da água é de aproximadamente 95 oC, sendo, portanto, maior que a temperatura ambiente (25 oC).
c- O ponto de ebulição normal da água é 100 oC e, para que isso ocorra, a pressão externa deve aumentar.




.jpg)