Questão 1
(UFMG) O hidróxido de amônio, em solução 10-3 M, apresenta grau de ionização 1% em temperatura ambiente. Sua constante de ionização valerá, aproximadamente, nessa temperatura:
a) 10-2
b) 106
c) 10-3
d) 10-7
e) 10-4
Questão 2
A constante de ionização de certo ácido a 25° C é 4,2×10-5. Calcule seu grau de dissociação iônica em solução 0,08 molar.
a) 9,211%
b) 1,922%
c) 2,291%
d) 2,921%
e) 2,192%
Questão 3
Uma solução 18% ionizada de um monoácido tem uma constante de ionização igual a Ki = 4,5×10-6. Calcule a concentração dessa solução em mols/litro.
a) 2,39.10-4 mol/L
b) 9,13.10-4 mol/L
c) 3,91.10-4 mol/L
d) 9,31.10-4 mol/L
e) 1,39.10-4 mol/L
Questão 4
(OSEC-SP) Sabendo-se que o grau de ionização (α) de uma solução 0,1 molar de ácido acético a 25° C é 1,35×10-2, podemos concluir que a constante de ionização do ácido acético, na mesma temperatura, é:
a) 1,84×10-3
b) 1,84×10-6
c) 1,37×10-2
d) 1,82×10-5
e) 1,52×10-4
Resposta Questão 1
Letra d). Dados fornecidos pelo exercício:
Concentração molar (M): 10-3 M;
Grau de ionização (α): 1% ou 0,01 (quando dividimos por 100);
Ki: ?
OBS.: A base utilizada no exercício é fraca, logo, devemos utilizar a expressão da lei de Ostwald da seguinte maneira:
Ki = α2.M
Ki = (0,01)2.10-3
Ki = (10-2)2.10-3
Ki = 10-4.10-3
Ki = 10-7
Resposta Questão 2
Letra c). Dados fornecidos pelo exercício:
Concentração molar (M): 0,08 molar;
Grau de ionização (α): ?
Ki: 4,2×10-5
OBS.: O ácido utilizado no exercício é fraco porque sua constante de ionização é menor ou igual a 10-5, logo, devemos utilizar a expressão da lei de Ostwald da seguinte maneira:
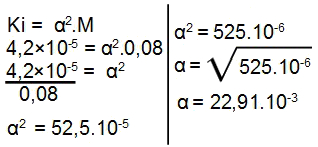
Quando multiplicamos o resultado por 100, temos o seguinte grau de ionização:
α = 22,91.10-3.100
α = 2,291%
Resposta Questão 3
Letra e). Dados fornecidos pelo exercício:
Concentração molar (M): ?
Grau de ionização (α): 18% ou 0,18 (quando dividimos por 100)
Ki: 4,5×10-6
OBS.: A base utilizada no exercício é fraca, logo, devemos utilizar a expressão da lei de Ostwald da seguinte maneira:
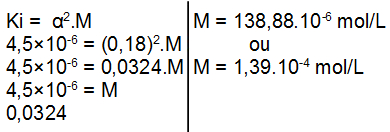
Resposta Questão 4
Letra d). Dados fornecidos pelo exercício:
Concentração molar (M): 0,1 molar;
Grau de ionização (α): 1,35×10-2
Ki: ?
OBS.: O ácido utilizado no exercício é fraco porque sua constante de ionização é menor ou igual à 10-5, logo, devemos utilizar a expressão da lei de Ostwald da seguinte maneira:
Ki = α2.M
Ki = (1,35×10-2)2.0,1
Ki = 1,8225.10-4.0,1
Ki = 1,8225.10-5



