Questão 1
Os átomos realizam as ligações químicas para atingir uma configuração eletrônica mais estável. Sabendo que um elemento químico X, de número atômico igual a 49, e um elemento Y, de número atômico igual a 53, combinam-se, a fórmula e o tipo de ligação do composto formado entre esses elementos são:
a) XY3 - covalente.
b) XY3 - iônica.
c) XY - iônica.
d) X3Y3 - iônica.
e) X3Y - covalente.
Questão 2
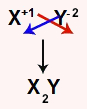
(FPS-PE) Quando átomos X com configuração eletrônica 1s2 2s2 2p6 3s2 reagem com átomos Y com configuração 1s2 2s2 2p5, há formação de cátions e ânions. Qual a valência dos cátions e ânions formados, respectivamente?
a) Monovalente e monovalente.
b) Monovalente e bivalente.
c) Bivalente e monovalente.
d) Bivalente e bivalente.
e) Bivalente e trivalente.
Questão 3
(PUC-SP) A primeira energia de ionização de um elemento (1ª E.I.) informa a energia necessária para retirar um elétron de um átomo neutro no estado gasoso, conforme indica a equação:
X(g) → X+(g) + e– E.I. = 7,6 eV
A segunda energia de ionização de um elemento (2ª E.I.) informa a energia necessária para retirar um elétron do cátion de carga +1 no estado gasoso, conforme indica a equação:
X+(g) → X2+(g) + e– E.I. = 15,0 eV
A tabela a seguir apresenta os valores das dez primeiras energias de ionização de dois elementos pertencentes ao 3º período da tabela periódica.
.jpg)
Analisando os dados da tabela, é possível afirmar que o tipo de ligação que ocorre entre os elementos X e Z e a fórmula do composto binário formado por esses elementos são, respectivamente,
a) ligação covalente, SiCl4.
b) ligação iônica, MgCl2.
c) ligação metálica, Mg3Al2.
d) ligação covalente, SCl2.
e) ligação iônica, Na2S.
Questão 4
Considere os elementos químicos genéricos A e B e suas respectivas distribuições eletrônicas:
X → 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Y → 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4
De acordo com os dados, conclui-se que o composto formado pela ligação química entre os elementos A e B apresentará fórmula igual a:
a) AB
b) A2B
c) AB2
d) A2B3
Resposta Questão 1
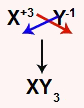
Letra b). A respeito dos elementos químicos fornecidos pelo exercício e seu posicionamento na Tabela Periódica, temos que:
Sobre o Elemento X:
-
Pertence à família IIIA;
-
É um metal
-
Possui três elétrons na camada de valência;
-
Sua forma iônica é X+3 (por ser metal e estar na família IIIA).
Sobre o elemento Y:
-
Pertence à família VIIA;
-
É um ametal;
-
Possui sete elétrons na camada de valência;
-
Sua forma iônica é Y-1 (por ser ametal e estar na família VIIA, ganha um elétron para atingir a estabilidade)
Como temos a interação entre um metal e um ametal, a ligação entre esses elementos é do tipo iônica. Para montar a fórmula do composto, basta escrever primeiro o metal, depois o ametal e cruzar as cargas:
Resposta Questão 2
Letra c). Para determinar a valência de um elemento químico por meio da sua distribuição eletrônica, basta conhecer sua camada de valência (nível mais distante do núcleo). Assim:
Sobre o elemento X: 1s2 2s2 2p6 3s2
-
Pela sua distribuição, a camada de valência é a terceira (3s2);
-
Existem dois elétrons na sua camada de valência;
-
Deve ser chamado de bivalente, pois ele deve perder os seus dois elétrons da camada de valência para atingir o octeto.
Sobre o elemento Y: 1s2 2s2 2p5
-
Pela sua distribuição, a camada de valência é a segunda (2s2 2p5);
-
Existem sete elétrons na sua camada de valência;
-
Deve ser chamado de monovalente, pois necessita de apenas mais um elétron para atingir o octeto.
Resposta Questão 3
Letra b). De acordo com o enunciado, os elementos X e Y estão no terceiro período da Tabela Periódica. Por isso, as opções de elementos nesse período são:
Sódio
Magnésio
Alumínio
Silício
Fósforo
Enxofre
Cloro
Argônio (gás nobre e, portanto, estável)
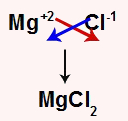
Analisando a tabela de valores de energia de ionização, temos:
Elemento X: só apresenta variação de energia acentuada após a retirada do segundo para o terceiro elétron, ou seja, ele apresenta dois elétrons na camada de valência e, por isso, é um metal alcalinoterroso (carga +2 (X+2)). Entre as opções de elementos do terceiro período, o único alcalinoterroso é o magnésio (Mg+2).
Elemento Y: só apresenta variação de energia acentuada entre a retirada do sétimo para o oitavo elétron, ou seja, ele apresenta sete elétrons na camada de valência e, por isso, é um halogênio (carga -1 (Y-1)). Entre as opções de elementos do terceiro período, o único halogênio é o cloro (Cl-1).
Como temos a interação entre um metal e um ametal, a ligação entre esses elementos é do tipo iônica. Para montar a fórmula do composto, basta escrever primeiro o metal, depois o ametal e cruzar as cargas:
Resposta Questão 4
Letra b). Para conhecer a fórmula do composto formado pelos elementos X e Y, é necessário antes conhecer o número de elétrons na camada de valência e quantas ligações eles precisam realizar:
Sobre o elemento X: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
-
Pela sua distribuição, a camada de valência é a quarta (5s1);
-
Existe um elétron na sua camada de valência;
-
Deve ser chamado de cátion monovalente, já que deve perder um elétron para completar o octeto;
-
Sua forma iônica é X-1.
Sobre o elemento Y: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4
-
Pela sua distribuição, a camada de valência é a quarta (4s2 4p4);
-
Existem seis elétrons na sua camada de valência;
-
Deve ser chamado de ânion bivalente, já que faltam dois elétrons para completar o octeto;
-
Sua forma iônica é o Y-2.
Como temos a interação entre um metal e um ametal, a ligação entre esses elementos é do tipo iônica. Para montar a fórmula do composto, basta escrever primeiro o metal, depois o ametal e cruzar as cargas: