Questão 1
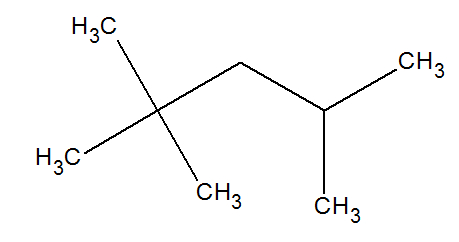
Dada a fórmula estrutural do isoctano, um dos principais componentes da gasolina, abaixo:
Quantos átomos de carbono com hibridização sp3 existem nessa molécula?
a) 4
b) 6
c) 5
d) 8
e) 7
Questão 2
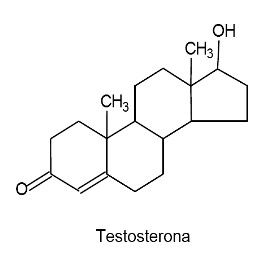
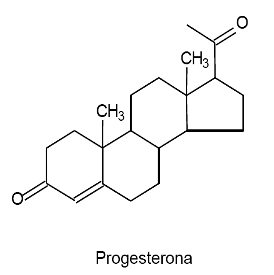
(UFPR) O átomo de carbono sofre três tipos de hibridação: sp3, sp2 e sp. Essa capacidade de combinação dos orbitais atômicos permite que o carbono realize ligações químicas com outros átomos, gerando um grande número de compostos orgânicos. A seguir, são ilustradas estruturas de dois compostos orgânicos que atuam como hormônios.
Acerca da hibridação dos átomos de carbono nos dois hormônios, considere as seguintes afirmativas:
1. A testosterona possui dois átomos de carbono com orbitais híbridos sp2.
2. A progesterona possui quatro átomos de carbono com orbitais híbridos sp2.
3. Ambos os compostos apresentam o mesmo número de átomos de carbono com orbitais híbridos sp3.
4. O número total de átomos de carbono com orbitais híbridos sp3 na testosterona é 16.
Assinale a alternativa correta.
a) Somente as afirmativas 1 e 3 são verdadeiras.
b) Somente as afirmativas 2 e 4 são verdadeiras.
c) Somente as afirmativas 2, 3 e 4 são verdadeiras.
d) Somente as afirmativas 1, 2 e 3 são verdadeiras.
e) As afirmativas 1, 2, 3 e 4 são verdadeiras.
Questão 3
Sobre a estrutura do metilbenzeno proposta abaixo:
Podemos afirmar que:
a) Todos os carbonos são hibridizados sp3.
b) Apenas um carbono presente na estrutura apresenta hibridização sp2.
c) Todos os carbonos apresentam hibridização sp2.
d) Todos os carbonos apresentam hibridização sp.
e) Apenas um carbono presente na estrutura apresenta hibridização sp3.
Questão 4
(ITA-SP) A(s) ligação(ões) carbono-hidrogênio existente(s) na molécula de metano (CH4) pode(m) ser interpretada(s) como sendo formada(s) pela interpenetração frontal dos orbitais atômicos s do átomo de hidrogênio, com os seguintes orbitais atômicos do átomo de carbono:
a) Quatro orbitais p.
b) Quatro orbitais híbridos sp3.
c) Um orbital híbrido sp3.
d) Um orbital s e três orbitais p.
e) Um orbital p e três orbitais sp2.
Resposta Questão 1
Letra d). Para que um carbono apresente hibridização do tipo sp3, é necessário que suas quatro ligações sejam do tipo sigma. No isoctano, todos os carbonos apresentam apenas ligações sigma, logo, todos eles apresentam hibridização sp3.
Resposta Questão 2
Letra b). A resposta é a alternativa B porque:
1- A testosterona apresenta três carbonos com hibridização sp2 (aqueles que realizam uma ligação pi), já que todos os outros átomos de carbono são do tipo sp3, isto é, fazem apenas ligações sigma.
3- É impossível as estruturas apresentarem o mesmo número de carbonos sp3, pois elas apresentam diferentes quantidades de carbonos que realizam ligações pi.
Resposta Questão 3
Letra e). Para que um carbono apresente hibridização do tipo sp3, é necessário que suas quatro ligações sejam do tipo sigma. No metilbenzeno, todos os carbonos do benzeno realizam uma ligação pi (localizada na ligação dupla). Portanto, essa estrutura apresenta apenas um carbono do tipo sp3.
Resposta Questão 4
Letra b). Como no metano o átomo de carbono realiza quatro ligações simples (sigma), já que esta é a única ligação covalente que o átomo de hidrogênio é capaz de realizar com o carbono, logo, a hibridização do carbono é do tipo sp3.




.jpg)
.jpg)