Questão 1
(UERJ) Compostos de enxofre são usados em diversos processos biológicos. Existem algumas bactérias que utilizam, na fase da captação de luz, o H2S em vez de água, produzindo enxofre no lugar de oxigênio, conforme a equação química:
6 CO2 + 12 H2S → C6H12O6 + 6 H2O + 12 S
O H2S é um gás que se dissolve em água. Essa solubilidade decorre da formação de interações moleculares do tipo:
a) iônica
b) covalente
c) dipolo-dipolo
d) ligação de hidrogênio
Questão 2
(UFC) A atividade contraceptiva dos DIUs (Diafragmas Intrauterinos) modernos é atribuída, em parte, à ação espermaticida de sais de cobre (II), que são gradativamente liberados por esses diafragmas no útero feminino. Quanto aos sais de cobre (II) em meio aquoso, assinale a alternativa correta.
a) Apresentam interações íon-dipolo.
b) Passam a se apresentar no estado líquido.
c) Envolvem interações entre espécies apolares.
d) A configuração eletrônica do íon cobre(II) é [Ar] 3d8.
e) O íon cobre(II) encontra-se na forma reduzida, Cu2–.
Questão 3
Após a análise das ligações químicas e das geometrias das moléculas CH4, CO2, SO2 e NH3, pode-se afirmar que as moléculas que apresentam forças intermoleculares dipolo-dipolo são somente: (Números atômicos: H = 1; C = 6; N = 7; S = 16)
a) CCl4 e SiO2.
b) CCl4 e BF3.
c) CCl3H e SO2.
d) BF3 e SiO2.
e) BF3 e SO2.
Questão 4
O tipo de força intermolecular entre as moléculas é determinado por dois importantes conceitos: a geometria molecular e a polaridade. Considere as substâncias dióxido de carbono (CO2), ácido sulfídrico (H2S), gás cloro (Cl2) e tricloreto de nitrogênio (Ncl3). Quais delas apresentam moléculas que interagem pela força intermolecular dipolo-dipolo?
a) CO2 e H2S.
b) Cl2 e H2S.
c) NCl3 e Cl2.
d) Cl2 e H2S.
e) H2S e NCl3.
Resposta Questão 1
Letra c). Como as moléculas do H2S são polares e o hidrogênio não está ligado aos elementos flúor, oxigênio e nitrogênio,elas interagem por força dipolo-dipolo.
A molécula do H2S é polar porque nela existem quatro nuvens: duas são as ligações simples entre o enxofre e os hidrogênios, e as outras duas são os quatro elétrons do enxofre que não estão realizando ligação:
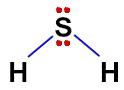
Resposta Questão 2
Letra a). Os sais apresentam sempre um cátion (que é um metal, no caso o cobre) interagindo com um ânion por meio de ligação iônica, sendo, portanto, uma estrutura polar. Como são polares, estabelecem interações dipolo-dipolo entre si. Com as moléculas de água, estabelecem interações íon-dipolo por apresentarem íons.
OBS.: A configuração eletrônica do íon cobre (Cu+2) é: 1s2 2s2 2p6 3s2 3p6 3d9.
Resposta Questão 3
Letra c). Para realizar interação dipolo-dipolo, a substância deve apresentar moléculas polares, o que não ocorre nas substâncias BF3, CCl4 e SiO2 porque, no átomo central delas, o número de nuvens é igual ao número de ligantes que pertencem ao mesmo elemento químico.
No BF3, temos três ligações simples (três nuvens) e três ligantes iguais (três átomos de flúor).
.jpg)
No SiO2, temos duas ligações duplas (duas nuvens) e dois ligantes iguais (dois átomos de oxigênio).
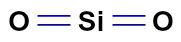
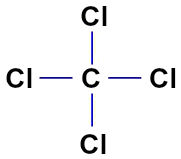
No CCl4, temos quatro ligações simples (quatro nuvens) e quatro ligantes iguais (quatro átomos de cloro).
Resposta Questão 4
Letra e). Para realizar interação dipolo-dipolo, a substância deve apresentar moléculas polares, o que não ocorre nas substâncias CO2 e Cl2 porque, no átomo central delas, o número de nuvens é igual ao número de ligantes que pertencem ao mesmo elemento químico.
No Cl2, temos apenas dois átomos do mesmo elemento químico interagindo.

No CO2, temos duas ligações duplas (duas nuvens) e dois ligantes iguais (dois átomos de oxigênio).
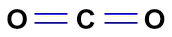

 Cadastrar
Cadastrar Logar
Logar

