Questão 1
Dadas as moléculas abaixo, indique a única que não segue a teoria do octeto.
a) CS2
b) CBr4
c) PCl3
d) BeH2
e) NH3
Questão 2
De acordo com a teoria do octeto, um átomo adquire estabilidade quando alcança a quantia de dois ou oito elétrons na camada de valência durante a realização de uma ligação química com um ou mais átomos. Existem, porém, situações em que alguns átomos não necessitam de oito elétrons para se tornarem estáveis, pois essa quantidade pode ser menor ou maior que oito elétrons. Baseando-se nesse fato, qual dos elementos listados é uma exceção à teoria do octeto?
a) Carbono
b) Oxigênio
c) Flúor
d) Nitrogênio
e) Boro
Questão 3
(PUC-SP) Qual das seguintes séries contém todos os compostos covalentes cuja estabilização ocorre sem que atinjam o octeto?
a) BeCl2, BF3, H3BO3, PCl5
b) CO, NH3, HClO, H2SO3
c) CO2, NH4OH, HClO2, H2SO4
d) HClO3, HNO3, H2CO3, SO2
e) HCl, HNO3, HCN, SO3
Questão 4
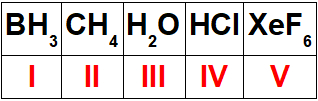
(PUC-RJ) Observa-se que, exceto o hidrogênio, os outros elementos dos grupos IA a VIIIA da tabela periódica tendem a formar ligações químicas de modo a preencher oito elétrons na última camada. Essa é a regra do octeto. Como toda regra tem exceção, assinale a opção que mostra somente moléculas que não obedecem a essa regra:
a) I, II e III
b) II, II e IV
c) IV e V
d) I e IV
e) I e V
Resposta Questão 1
Letra d)
O hidreto de berílio (BeH2) não segue a teoria do octeto, porque o berílio é um elemento da família IIA, apresentando, por isso, dois elétrons na camada de valência. Ao se ligar com dois hidrogênios, elemento que necessita de compartilhar um elétron para se estabilizar, o berílio acaba estabilizando-se com quatro elétrons.
As outras alternativas estão corretas, porque:
a- O carbono (C), por ser da família IVA, possui quatro elétrons na camada de valência. Ao se ligar com dois enxofres, elemento pertencente à família VIA, que possui seis elétrons de valência e necessita de dois elétrons para se estabilizar, atinge oito elétrons, ou seja, atinge o octeto.
b- O carbono, ao se ligar com quatro bromos, elemento pertencente à família VIIA, que possui sete elétrons de valência e que necessita de apenas um elétron para se estabilizar, atinge oito elétrons, ou seja, atinge o octeto.
c- O fósforo (P), por ser da família VA, possui cinco elétrons na camada de valência e, ao se ligar com três cloros (elemento pertence à família VIIA), atinge oito elétrons, ou seja, atinge o octeto.
e- O nitrogênio (N), por ser da família VA, possui cinco elétrons na camada de valência e, ao se ligar com três cloros (elemento pertence à família VIIA), atinge oito elétrons, ou seja, atinge o octeto.
Resposta Questão 2
Letra e)
O boro é uma exceção à regra do octeto. Por pertencer à família IIIA, apresenta três elétrons na camada de valência e necessita de apenas outros três elétrons para se estabilizar. Logo, o boro estabiliza-se com seis elétrons.
Resposta Questão 3
Letra a)
Berílio e boro são elementos que nunca seguem o octeto, portanto, seus compostos também não obedecerão à regra do octeto. Em relação ao elemento fósforo (P), o composto PCl5 não segue à regra do octeto. Por ser da família VIA, o fósforo possui cinco elétrons na camada de valência e, ao se ligar com cinco cloros, atinge dez elétrons, ou seja, não obedece ao octeto.
Resposta Questão 4
Letra e)
Apenas as estruturas I e V não seguem o octeto, porque:
I- O boro (B), por ser da família IIIA, possui três elétrons na camada de valência e, ao se ligar com três hidrogênios, elemento que necessita de um elétron para se estabilizar com um total de dois elétrons, atinge seis elétrons, ou seja, não obedece ao octeto.
II- O carbono (C), por ser da família IVA, possui quatro elétrons na camada de valência e, ao se ligar com quatro hidrogênios, atinge oito elétrons, ou seja, atinge o octeto.
III- O oxigênio (O), por ser da família VIA, possui seis elétrons na camada de valência e, ao se ligar com dois hidrogênios, atinge oito elétrons, ou seja, atinge o octeto.
IV- O cloro (Cl), por ser da família VIIA, possui sete elétrons na camada de valência e, ao se ligar com um hidrogênio, atinge oito elétrons, ou seja, atinge o octeto.
V- O xenônio (Xe), por ser da família VIIIA, possui oito elétrons na camada de valência, ou seja, já é estável. Ao se ligar com seis átomos de flúor, elemento que necessita de compartilhar um elétron por ser da família VIIA, o xenônio fica estável com quatorze elétrons, ou seja, não obedece ao octeto.