Questão 1
Quando o ácido cianídrico é dissolvido em água, sofre ionização (formando os íons hidrônio e cianeto), o que resulta no seguinte equilíbrio iônico:
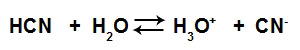
A concentração de íons CN- aumentará se adicionarmos à solução:
a) um ácido forte
b) uma base forte
c) um sal formado a partir de íons provenientes de ácido e base fortes
d) um óxido inorgânico qualquer
e) um solvente orgânico
Questão 2
Qual alternativa apresenta uma substância capaz de aumentar a concentração do íons carbonato (CO3-2) no equilíbrio abaixo?
.jpg)
a) HBr
b) HNO3
c) KOH
d) H2O
e) n.d.a.
Questão 3
(PUC-RS) Considere o equilíbrio químico que se estabelece em uma solução aquosa de ácido acético que pode ser representada pela equação:
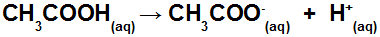
Mantendo-se constante a temperatura e adicionando-se uma solução aquosa de acetato de sódio, de fórmula CH3COONa, é incorreto afirmar que
a) o equilíbrio se desloca para a esquerda.
b) aumenta a concentração de CH3COOH.
c) aumenta a concentração do íon CH3COO-.
d) diminui a concentração do íon H+.
e) altera o valor numérico da constante de equilíbrio.
Questão 4
(UFV-MG) Considere uma solução aquosa de íons cromato (CrO42-) e dicromato (Cr2O7-4), em equilíbrio, conforme equação abaixo:
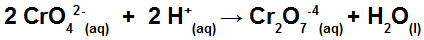
Assinale a afirmativa CORRETA:
a) A adição de NaOH favorecerá a formação de íons dicromato.
b) A redução no valor do pH favorecerá a formação de íons cromato.
c) A equação acima representa uma reação de oxirredução.
d) A diluição da solução não causa deslocamento no equilíbrio químico do sistema.
e) A adição de H2SO4 deslocará o equilíbrio químico para a direita.
Resposta Questão 1
Letra b). Para aumentar a concentração de íons CN-, o equilíbrio deve ser deslocado à direita, o que ocorre quando adicionamos uma base forte a ele. A base forte introduz o ânion OH- no equilíbrio, íon que interage com o H3O+, diminuindo sua quantidade e, por isso, deslocando o equilíbrio para a direita.
Resposta Questão 2
Letra c). Para aumentar a concentração de íons carbonato (CO3-2), é necessário adicionar uma substância capaz de deslocar o equilíbrio para a direita, que é o caso do KOH. O KOH é uma base forte (por apresentar elemento da família IA) e introduz no equilíbrio íons OH-, aumentando a concentração destes e deslocando o equilíbrio para a direita. As outras alternativas estão incorretas porque:
a) e b) Possuem ácidos fortes, os quais adicionariam o íon H+, que reagiria com os íons OH-, diminuindo a quantidade destes e deslocando o equilíbrio para a esquerda.
d) A adição de água ao sistema deslocaria o equilíbrio para a esquerda.
Resposta Questão 3
Letra e). O único fator capaz de alterar a constante de equilíbrio é a mudança de temperatura. As outras alternativas estão corretas porque:
a), b) e c) O sal adicionado apresenta o íon acetato (CH3COO-), que está do lado direito, logo, aumentando a sua concentração, o equilíbrio deve ser deslocado para a esquerda.
c) O íon acetato está presente no sal.
d) Como o equilíbrio é deslocado para a esquerda, logo, a concentração de H+ é diminuída.
Resposta Questão 4
Letra e). O H2SO4 é um ácido forte e, por isso, ele aumenta a concentração de H+ no meio, deslocando o equilíbrio para a direita. As outras alternativas estão incorretas porque:
a) A adição de NaOH introduz OH- no equilíbrio, que interage com o H+, diminuindo sua concentração. Logo, o equilíbrio é deslocado para a esquerda, formando íon cromato (CrO4-2)
b) Redução de pH indica aumento da quantidade de H+, logo, esse equilíbrio é deslocado para a direita, onde temos o íon dicromato (Cr2O7-4).
c) Oxigênio em íons oxigenados tem sempre NOX -2. O Hidrogênio no H2O apresenta NOX +1, o que sempre ocorre com o H+, logo, só poderia ocorrer alteração no NOX do Cr, sendo oxidação ou redução, e não os dois.
d) Diluição indica aumenta da concentração de água, logo, o equilíbrio seria deslocado para a esquerda.



