Questão 1
(PUC) Uma solução aquosa de nitrato de prata (0,050 mol L -1) é usada para se determinar, por titulação, a concentração de cloreto em uma amostra aquosa. Exatos 10,00 mL da solução titulante foram requeridos para reagir com os íons Cl- presentes em 50,00 mL de amostra. Assinale a concentração, em mol L-1, de cloreto, considerando que nenhum outro íon na solução da amostra reagiria com o titulante.
Dado: Ag+ (aq) + Cl- (aq) → AgCl(s)
A) 0,005
B) 0,010
C) 0,025
D) 0,050
E) 0,100
Questão 2
(UEA) Na diluição de 100 mL de uma solução de hidróxido de sódio (NaOH), de concentração 20 g/L, adicionou-se água até completar o volume de 250 mL. O valor da concentração da solução após a diluição equivale a:
A) 13,3 g/L.
B) 30,0 g/L.
C) 6,6 g/L.
D) 8,0 g/L.
E) 50,0 g/L.
Questão 3
(IFTO) Em um laboratório, deseja-se preparar 500 mL de uma solução de ácido clorídrico, HCl, a uma concentração de 0,1 mol.L-1. Para isso, tem-se disponível apenas um frasco de 1 L de solução estoque do ácido a 0,4 mol.L-1. Desta forma, o volume, em litros, da solução estoque a ser retirado para se formar a nova solução é de:
A) 1,25.
B) 2,0.
C) 0,2.
D) 0,125.
E) 0,02.
Questão 4
(UEG) Uma solução estoque de hidróxido de sódio foi preparada pela dissolução de 4 g do soluto em água, obtendo-se ao final 100 mL e, posteriormente, determinado volume foi diluído para 250 mL obtendo-se uma nova solução de concentração igual a 0,15 mol.L-1.
O volume diluído, em mL, da solução estoque é aproximadamente:
A) 26
B) 37
C) 50
D) 75
Questão 5
Um engenheiro químico precisa ajustar a concentração de um aditivo anticorrosivo utilizado na refrigeração de motores industriais. Ele tem 2 L de uma solução do aditivo a 1,5 mol/L e precisa reduzi-la para 0,5 mol/L. Qual deve ser o volume final da solução após a diluição?
A) 3,0 L
B) 4,0 L
C) 5,0 L
D) 6,0 L
E) 7,0 L
Questão 6
Uma fábrica de cosméticos precisa diluir um extrato concentrado de essência de lavanda para a produção de perfumes. Se 300 mL do extrato possuem concentração de 0,5 mol/L e precisam ser diluídos até 1,5 L, qual será a nova concentração da solução?
A) 0,05 mol/L
B) 0,20 mol/L
C) 0,15 mol/L
D) 0,25 mol/L
E) 0,10 mol/L
Questão 7
Durante uma análise em laboratório, foi preparada uma solução aquosa de sacarose (C12H22O11) dissolvendo-se 68,4 g do soluto em 0,5 L de água. Considerando que a massa molar da sacarose é 342 g/mol, qual a concentração em mol/L dessa solução?
A) 0,1
B) 0,2
C) 0,3
D) 0,4
E) 0,5
Questão 8
Um frasco contém 600 mL de uma solução 0,75 mol/L de ácido fosfórico (H3PO4). O técnico do laboratório deseja diluí-la até um volume final de 1,5 L. Qual será a nova concentração da solução?
A) 0,32 mol/L
B) 0,25 mol/L
C) 0,30 mol/L
D) 0,20 mol/L
Questão 9
Uma solução de ácido acético (CH3COOH) foi preparada dissolvendo-se 12 g do ácido em água até completar 200 mL. Em seguida, 50 mL dessa solução foram diluídos para 500 mL. Qual é a concentração da solução final em g/L?
(Dado: massa molar do CH3COOH = 60 g/mol.)
A) 0,6 g/L
B) 1,2 g/L
C) 2,4 g/L
D) 6,0 g/L
E) 12,0 g/L
Questão 10
Durante um experimento em um laboratório forense, um perito precisa preparar 200 mL de uma solução de luminol a 0,02 mol/L para testes de detecção de sangue. Ele dispõe apenas de uma solução estoque de luminol a 0,1 mol/L. Qual volume da solução estoque deve ser utilizado para a diluição?
A) 4 mL
B) 0,4 mL
C) 40 mL
D) 400 mL
E) 0,04 mL
Questão 11
Durante a análise de uma amostra de vinagre, 25,00 mL foram titulados com uma solução padronizada de hidróxido de sódio (NaOH) a 0,10 mol/L. Nesse contexto, foram necessários exatamente 30,00 mL da solução de NaOH para completar a reação de neutralização. Diante disso, determine a concentração, em mol/L, do ácido acético (CH3COOH) na amostra.
A) 0,12 mol/L
B) 0,10 mol/L
C) 0,05 mol/L
D) 12,0 mol/L
E) 1,20 mol/L
Questão 12
Considere as seguintes situações em um laboratório:
- Um químico dissolve 5 g de cloreto de sódio (NaCl) em 100 mL de água, preparando uma solução aquosa.
- Outro químico utiliza 30 mL de uma solução de NaCl com concentração 2,0 mol/L e adiciona água destilada até completar 150 mL.
Sobre as duas situações descritas, analise as afirmações abaixo:
A) Ambas as situações representam exemplos de diluição de soluções, pois envolvem o preparo de soluções aquosas.
B) As situações 1 e 2 representam dissoluções, pois em ambas há a formação de uma solução com a presença de água como solvente.
C) Apenas a situação 1 corresponde a um processo de diluição, pois houve dissolução de soluto sólido em água.
D) Nenhuma das situações corresponde a um processo de diluição, já que a concentração inicial do soluto não foi mantida.
E) Apenas a situação 2 corresponde a um processo de diluição, pois o volume da solução foi aumentado com a redução da concentração do soluto.
Resposta Questão 1
Alternativa B.
Repare que a proporção em que a reação acontece é de 1:1 (1 mol de Ag+ para 1 mol de Cl-). Caso fosse 2:1, por exemplo, a concentração de Cl‑ seria metade da concentração de Ag+. Na titulação, para determinar o volume ou a concentração desconhecida de uma das soluções reagentes, basta aplicar a fórmula da diluição: C1 x V1 = C2 x V2. Nesse caso, chamaremos o titulante (nitrato de prata) de C(AgNO3) x V(AgNO3), e o titulado (cloreto), de C(Cl) x V(Cl):
0,050 x 10 = C(Cl) x 50
\(C(Cl) =\frac{0,05 x 10}{50} = 0,01 mol/L\)
Portanto, alternativa B.
Resposta Questão 2
Alternativa D.
Aplicando a fórmula da diluição (C1 x V1 = C2 x V2), temos:
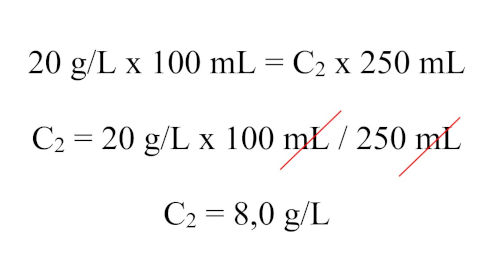
Resposta Questão 3
Alternativa D.
Perceba que nesse caso a questão pede o volume em litros da solução final. Sendo assim, você tem duas opções: converter o volume dado em mL para litros no início ou no final do cálculo. Por opção, faremos isso no final:

Resposta Questão 4
Alternativa B.
Primeiramente é necessário calcular a concentração molar (M) da solução estoque de hidróxido de sódio (NaOH). Para isso, precisamos determinar o número de mols contidos em 4g de NaOH a partir de sua massa molar: mm = 40,0 g.
Sendo assim, temos: n = m / mm n = 4 / 40 = 0,1 mol.
Assim, a concentração da solução estoque é: M = 0,1 mol / 0,1 L (100mL) M = 1,0 mol/L.
Diante disso, o volume de NaOH diluído para obter 0,15 mol/L em 250 mL foi:
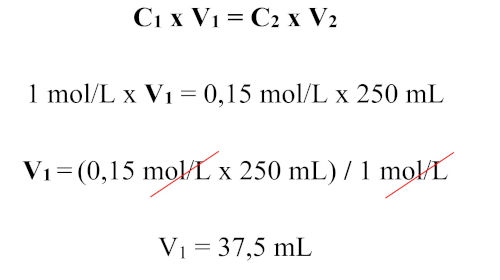
Resposta Questão 5
Alternativa B.
Por se tratar de diluição, temos: C1 x V1 = C2 x V2. Substituindo os valores na fórmula:
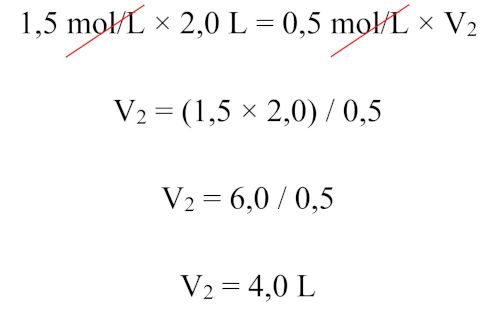
Portanto, a alternativa correta é a alternativa B.
Resposta Questão 6
Alternativa E.
Aplicando os dados informados na fórmula da diluição, temos:
0,5 mol/L × 300 mL = C2 × 1500 mL
C2 = (0,5 × 300) / 1500
C2 = 0,10 mol/L
Resposta Questão 7
Alternativa A.
A concentração em mol/L é dada por C = n / V; contudo, primeiro devemos encontrar o número de mols do soluto, sabendo que n = m / M.
n = 68,4 g / 342 g/mol
n = 0,2 mol
Logo, a concentração molar será:
C = 0,2 mol / 0,5 L
C = 0,1 mol/L
Resposta Questão 8
Alternativa C.
Tendo em vista que é informada a concentração e volume iniciais do ácido, aplica-se a equação da diluição para obter a concentração final após a diluição: C1 x V1 = C2 x V2.
0,75 mol/L × 600 mL = C2 × 1500 mL
C2 = (0,75 × 600) / 1500
C2 = 0,30 mol/L
Resposta Questão 9
Alternativa D.
Nesse caso o princípio da diluição é mesmo, a diferença é que aqui será dado em g/L:
C1 x V1 = C2 x V2
60 x 50 = C2 x 500
C2 = (60 x 50) / 500
C2 = 6,0 g/L
Resposta Questão 10
Alternativa C.
Sem delongas, aplicaremos a equação da diluição: C1 x V1 = C2 x V2.
0,1 mol/L x V1 = 0,02 mol/L x 200 mL
V1 = (0,02 × 200) / 0,1
V1 = 40 mL
Resposta Questão 11
Alternativa A.
Perceba que a reação acontece na proporção de 1:1, sendo assim:
C(CH3COOH) x V(CH3COOH) = C(NaOH) x V(NaOH)
C(CH3COOH) x 25,00 mL = 0,10 mol/L x 30,00 mL
C(CH3COOH) = (0,10 mol/L x 30,00 mL) / 25,00 mL
C(CH3COOH) = 0,12 mol/L
Resposta Questão 12
Alternativa E.
Vamos analisar os dois casos:
Na primeira situação, ocorre a dissolução de NaCl sólido em água. Isso não é diluição, pois diluição é caracterizada pela adição de solvente (como água) em uma solução já preparada, com o objetivo de diminuir sua concentração. Por outro lado, na segunda situação ocorre a diluição de uma solução já preparada, pois há aumento do volume da solução com redução da concentração do soluto, mantendo-se a quantidade de soluto constante. Portanto, alternativa E.



