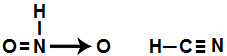Questão 1
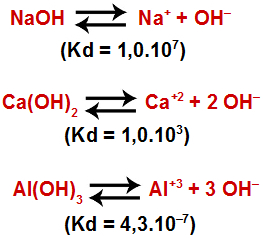
A seguir, são fornecidas as equações do equilíbrio químico e as constantes de dissociação referentes à adição de três bases à água, à 25 oC:
Sobre esses equilíbrios, são feitas as seguintes afirmações:
I. O hidróxido de sódio é o que apresenta maior dissociação.
II. O hidróxido de cálcio é uma base mais forte que o hidróxido de sódio.
III. A ordem de basicidade para essas substâncias é NaOH > Ca(OH)2 > Al(OH)3 .
IV. O hidróxido de alumínio possui uma maior tendência em liberar íons OH- que o hidróxido de cálcio.
Estão corretas:
a) III
b) I, III e IV
c) I, II e IV
d) I e II
e) I e III
Questão 2
Veja a seguinte tabela com a constante de ionização de quatro oxiácidos formados por cloro:
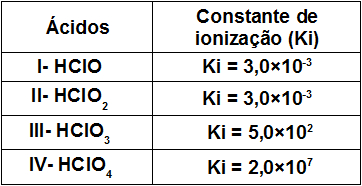
Analisando essa tabela, podemos verificar que:
a) Entre os ácidos fornecidos, o HClO3 é um exemplo de ácido moderado.
b) O ácido mais fraco é o HClO3.
c) O ácido HClO3 é mais fraco que o HClO.
d) O ácido HClO2 produz mais cátions H3O+ em água do que o HClO3.
e) O ácido que mais ioniza em água é o HClO4.
Questão 3
(Uefs-BA) Dadas as constantes de ionização de alguns ácidos em soluções aquosas, de mesma concentração molar:
.jpg)
Os ácidos são substâncias químicas que se ionizam e liberam íons H+ em solução aquosa. A constante de ionização de um ácido, Ka, expressa a tendência do equilíbrio químico para a reação reversível de ionização de ácidos em solução aquosa. Considerando-se as propriedades dos ácidos e a análise das informações da tabela, é correto concluir:
a) A reação de ionização do ácido fluorídrico produz mais íons em solução do que a do ácido nitroso.
b) A solução de HCN(aq) conduz corrente elétrica com mais eficiência do que a solução de HF(aq) de mesma concentração.
c) A substância química com maior tendência de liberar íons H+ em solução aquosa, dentre as apresentadas na tabela, é o HNO2.
d) O ácido fluorídrico é classificado como um hidrácido forte porque, em solução aquosa, a concentração de íons H3O+ é maior do que a de moléculas de HF.
e) O HNO2 e HCN são representados pelas fórmulas estruturais:
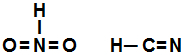
Questão 4
(Udesc-SC) O grau de ionização (α) indica a porcentagem das moléculas dissolvidas na água que sofreram ionização, sendo que a constante de ionização Ka indica se um ácido é forte, moderado ou fraco. Partindo desses pressupostos, escolha a alternativa abaixo que apresenta a ordem decrescente de ionização dos ácidos, considerando soluções aquosas a 1mol/L HCN (Ka = 6,1x10–10), HF (Ka = 6,3x10–4), CH3COOH (Ka = 1,8x10–5) e HClO4 (Ka = 39,8):
a) HCN > CH3COOH > HF > HClO4
b) HClO4 > CH3COOH > HF > HCN
c) HF > CH3COOH > HClO4 > HCN
d) HCN > HClO4 > HF > CH3COOH
e) HClO4 > HF > CH3COOH > HCN
Resposta Questão 1
Letra e). Essa é a alternativa correta porque:
I- Verdadeiro: o hidróxido de sódio é o que apresenta a maior constante de dissociação, logo possui a maior dissociação.
II- Falso: o hidróxido de cálcio [Ca(OH)2] não é uma base mais forte que o hidróxido de sódio (NaOH) porque a sua constante de dissociação é menor.
III- Verdadeiro, pois o hidróxido de sódio (NaOH) apresenta a maior constante de dissociação, portanto, é o mais forte, e o hidróxido de alumínio [Al(OH)3] apresenta a menor constante de dissociação e, por isso, é o mais fraco.
IV- Falso: o hidróxido de alumínio [Al(OH)3] possui uma constante de dissociação menor que a do hidróxido de cálcio [Ca(OH)2], logo sua capacidade em liberar íons em água é menor.
Resposta Questão 2
Letra e).
a- Falsa: o HClO3 é um dos ácidos mais fortes entre os ácidos fornecidos, já que sua constante de ionização é maior que o referencial 10-5.
b- Falsa: o HClO é o ácido mais fraco entre os ácidos fornecidos porque sua constante de ionização é a menor.
c- Falsa: o ácido HClO3 é mais forte do que o ácido HClO porque sua constante de ionização é maior.
d- Falsa: o ácido HClO2 não produz mais cátions H3O+ em água do que o HClO3 porque sua constante de ionização é menor.
e- Verdadeira: o HClO4 é o que mais ioniza por apresentar a maior constante de ionização.
Resposta Questão 3
Letra c). A resposta é a letra C porque:
a- Falsa: a reação de ionização do ácido fluorídrico não produz mais íons em água do que o ácido nitroso porque a constante de ionização do ácido nitroso é maior.
b- Falsa: a solução de HCN não conduz corrente elétrica com mais eficiência do que a solução de HF na mesma concentração porque sua constante de ionização é menor, logo a quantidade de íons que ele produz em água é baixa.
c- Verdadeira, pois o HNO2 possui a maior constante de ionização.
d- Falsa: o HF não é considerado um hidrácido forte porque sua constante de ionização é baixa, logo, quando em água, a quantidade de moléculas de HF é maior do que a de íons H3O+.
e- Falsa, pois as fórmulas estruturais corretas para os ácidos HNO2 e o HCN são:
Resposta Questão 4
Letra e). O enunciado pede para colocar os ácidos em ordem decrescente de ionização. Para isso, devemos levar em consideração o valor da constante de ionização de cada um deles. Quanto maior o valor da constante de ionização, mais forte é o ácido. Assim:
Mais forte: HClO4, por ter a maior constante de ionização;
Segundo mais forte: HF, por ter a segunda maior constante de ionização;
Terceiro mais forte: CH3COOH;
Mais fraco: HCN, por ter a menor constante de ionização.