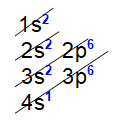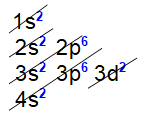Questão 1
O ouro foi um dos primeiros elementos a serem descobertos pelo homem (2600 a.C), junto com o carbono, mercúrio, ferro, prata, cobre e outros. Por volta de 1400 a.C., o ouro teve sua aplicação no Egito e era usado para valorizar os sarcófagos das múmias dos faraós. Por esse e outros motivos, o ouro mereceu lugar de destaque por ser um metal precioso de beleza característica. Esse metal pode ser encontrado livremente na natureza, conhecido como ouro nativo. Estima-se que existam cinco quilates de ouro para cada milhão de toneladas de terra, por isso esse elemento é tão raro. Analisando as características atômicas, qual seria a camada de valência de um átomo de ouro?
a) [Xe] 6s2, 5d7
b) [Xe] 6s2, 5d9
c) [Xe] 6s2, 5d8
d) [Xe] 5d10
e) [Xe] 5d10
Questão 2
O elemento químico potássio possui símbolo atômico K, número atômico 19 (19 prótons e 19 elétrons) e massa atômica 39 u. O potássio pertence à classe dos metais Alcalinos e, como membro dessa família, obedece às características dela: é leve, funde-se a baixas temperaturas e recebe a denominação de alcalino porque, durante reação com água, forma uma base alcalina. Esse elemento tem coloração branco-prateada, é um metal abundante na natureza, cujas fontes principais são as águas salgadas e minerais. Com relação à camada de valência dos átomos de potássio, quantos elétrons estão presentes?
a) 1
b) 2
c) 3
d) 4
e) 5
Questão 3
(UCS-RS) Os dias dos carros com luzes azuis estão contados, pois, desde 1º de janeiro de 2009, as lâmpadas de xenônio (54Xe) não podem mais ser instaladas em faróis convencionais. Mesmo que as lâmpadas azuis possibilitem três vezes mais luminosidade do que as convencionais, elas não se adaptam adequadamente aos refletores feitos para o uso com lâmpadas convencionais, podendo causar ofuscamento à visão dos motoristas que trafegam em sentido contrário e possibilitando, assim, a ocorrência de acidentes. Quantos elétrons o gás xenônio apresenta na camada de valência?
a) 2
b) 6
c) 8
d) 10
e) 18
Questão 4
(UFES) Ligas de titânio (22Ti) são muito utilizadas na fabricação de parafusos e pinos que compõem as próteses ortopédicas. A configuração eletrônica correta do átomo de titânio é:
a) [Ar] 3d4
b) [Ar] 3d6
c) [Ar] 4s1, 3d3
d) [Ar] 4s2, 3d2
e) [Ar] 4s2, 3d5
Resposta Questão 1
Letra b). Para determinar a camada de valência, é interessante realizar a distribuição eletrônica do átomo de ouro no diagrama de Linus Pauling, lembrando que o subnível s comporta 2 elétrons, o p comporta 6 elétrons, d comporta 10 elétrons e f comporta 14 elétrons. Assim:
Nessa distribuição, podemos observar que o nível mais distante do ouro é o 6s2, e o último subnível preenchido após ele é o 5d9. Sempre que a distribuição eletrônica de um átomo acabe no subnível d, sua camada de valência abrangerá o último subnível s preenchido e o subnível d.
Resposta Questão 2
Letra a). Para determinar o número de elétrons na camada de valência de um átomo de potássio, devemos realizar a sua distribuição eletrônica:
Analisando essa distribuição, observamos que o nível mais distante nesse átomo é o 4o, no qual temos a presença apenas do subnível s, que contém um elétron. Logo, o átomo de potássio possui um elétron na sua camada de valência.
Resposta Questão 3
Letra c). Para determinar o número de elétrons na camada de valência de um átomo de xenônio, devemos realizar a sua distribuição eletrônica:
Analisando essa distribuição eletrônica, observamos que o nível mais distante nesse átomo é o 5o, no qual temos a presença dos subníveis s e p, contendo, respectivamente, 2 e 6 elétrons. O átomo de xenônio, portanto, possui oito elétrons na sua camada de valência.
Resposta Questão 4
Letra d). Para determinar essa configuração, é interessante realizar a distribuição eletrônica do átomo de titânio no diagrama de Linus Pauling, lembrando que o subnível s comporta 2 elétrons, o p comporta 6 elétrons e o d comporta 10 elétrons. Assim:
Nessa distribuição, podemos observar que o nível mais distante do titânio é o 4s2, e o último subnível preenchido após ele é o 3d2. Sempre que a distribuição eletrônica de um átomo termine no subnível d, sua camada de valência abrangerá o último subnível s preenchido e o subnível d.




.jpg)