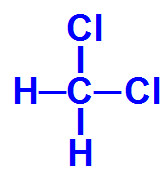
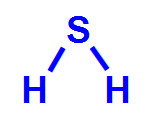
Questão 1
(FCChagas - BA) Para explicar moléculas polares, foram citadas as de
I. metano CH4
II. monoclorometano CH3Cl
III. diclorometano CH2Cl2
IV. triclorometano CHCl3
V. tretraclorometano CCl4
Na realidade, são polares apenas as moléculas designadas por:
a) I e IV
b) II e IV
c) III e V
d) I, II e V
e) II, III e IV
Questão 2
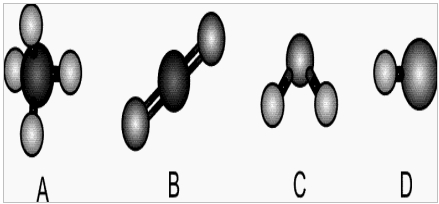
(Fuvest-SP) A figura mostra modelos de algumas moléculas com ligações covalentes entre seus átomos.
Analise a polaridade dessas moléculas, sabendo que tal propriedade depende da diferença de eletronegatividade entre os átomos que estão diretamente ligados entre si. Nas moléculas apresentadas, átomos de elementos diferentes têm eletronegatividades diferentes.
Observação: Eletronegatividade é a capacidade de um átomo atrair os elétrons da ligação covalente.
Entre essas moléculas, pode-se afirmar que são polares apenas:
a) A e B
b) A e C
c) A, C e D
d) B, C e D
e) C e D
Questão 3
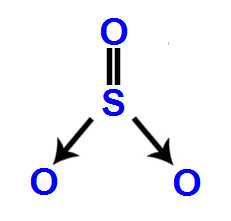
A indústria química, de uma forma geral, faz bastante uso dos gases amônia, dióxido de carbono e o trióxido de enxofre, os quais apresentam, respectivamente, as seguintes fórmulas moleculares NH3, CO2 e SO3. Qual das alternativas a seguir apresenta a verdadeira relação com a polaridade das três substâncias citadas?
a) apolar, polar e apolar.
b) polar, apolar e polar.
c) apolar, apolar e polar.
d) polar, polar e apolar.
e) polar, apolar e apolar.
Questão 4
Dadas as moléculas abaixo:
I- HCl
II- H2O
III- NH3
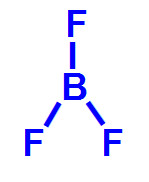
IV- BF3
V- CH4
VI-CH2Cl2
VII- H2S
VIII- BeCl2
Podemos afirmar que são polares:
a) somente I, II, VI e VIII.
b) somente I, III, IV, V e VIIII.
c) somente I, II, III, VI e VII.
d) somente I, II, III, IV, VII.
e) todas.
Resposta Questão 1
Letra e). Todas as moléculas fornecidas pelo exercício são pentatômicas, ou seja, formadas por cinco átomos, o que caracteriza um átomo ligado a outros quatro, em uma geometria tetraédrica. Para determinar se a molécula com essa geometria é polar, basta que dois dos átomos ligados ao átomo central sejam diferentes entre si, o que ocorre nas moléculas de II a IV.
Resposta Questão 2
Letra e). A resposta é a letra e, que está baseada na seguinte análise:
Molécula A: sua geometria é tetraédrica, e apresenta quatro ligantes iguais, logo, trata-se de uma molécula apolar.
Molécula B: é uma molécula linear que apresenta dois átomos iguais ligados ao átomo central. Porém, como sua geometria é linear, o número de nuvens eletrônicas no átomo central é igual ao número de ligantes iguais, o que torna essa molécula apolar.
Molécula C: Possui geometria angular, com dois átomos iguais ligados ao átomo central. Como sua geometria é angular, o número de nuvens eletrônicas no átomo central é diferente do número de ligantes iguais, assim, a molécula é polar.
Molécula D: é diatômica (dois átomos), formada por átomos de elementos diferentes, portanto, é polar.
Resposta Questão 3
Letra e). A resposta é a alternativa e, porque cada uma das moléculas apresentadas possui as seguintes características:
NH3: Na molécula de amônia, o nitrogênio realiza três ligações simples, uma com cada hidrogênio. Como ele apresenta cinco elétrons na camada de valência, nessa molécula, há três ligantes iguais e quatro nuvens (três ligações e um par de elétrons não ligantes). Portanto, trata-se de uma molécula polar.
CO2: Na molécula de dióxido de carbono, o carbono realiza duas ligações duplas, uma com cada oxigênio. Como ele apresenta quatro elétrons na camada de valência, nessa molécula, há dois ligantes iguais e duas nuvens (duas ligações) eletrônicas. Assim, trata-se de uma molécula apolar.
SO3: Na molécula de trióxido de enxofre, o enxofre realiza uma ligação dupla e duas ligações dativas (nas quais são utilizados dois elétrons do oxigênio), uma com cada oxigênio. Como ele apresenta seis elétrons na camada de valência, nessa molécula, existem três ligantes iguais e três nuvens (três ligações). Trata-se, portanto, de uma molécula apolar.
Resposta Questão 4
Letra c). A resposta é a letra c, porque:
I- É diatômica (dois átomos), formada por átomos de elementos diferentes, e, por isso, é polar.
II- Na molécula de água, o oxigênio realiza duas ligações simples, uma com cada hidrogênio. Como ele apresenta seis elétrons na camada de valência, nessa molécula, existem dois ligantes iguais e quatro nuvens (duas ligações e dois pares de elétrons não ligantes). Assim, é uma molécula polar.
H2O
III- Na molécula de amônia, o nitrogênio realiza três ligações simples, uma com cada hidrogênio. Como ele apresenta cinco elétrons na camada de valência, nessa molécula, há três ligantes iguais e quatro nuvens (três ligações e um par de elétrons não ligantes). Dessa forma, é uma molécula polar.
IV- Na molécula de trifluoreto de boro, o boro realiza três ligações simples, uma com cada flúor. Como ele apresenta três elétrons na camada de valência, nessa molécula, existem três ligantes iguais e três nuvens (três ligações). Por tudo isso, é uma molécula apolar.
V- Sua geometria é tetraédrica, pois a molécula é pentatômica e apresenta quatro ligantes no átomo central. Como os quatro ligantes no átomo central são iguais, e existem apenas quatro nuvens eletrônicas (quatro ligações), trata-se de uma molécula apolar.
VI- Sua geometria é tetraédrica, pois a molécula é pentatômica e apresenta quatro ligantes no átomo central. Como os quatro ligantes no átomo central não são iguais, e existem apenas quatro nuvens eletrônicas (quatro ligações), trata-se de uma molécula polar.
VII- Na molécula de ácido sulfídrico, o enxofre realiza duas ligações simples, uma com cada hidrogênio. Como ele apresenta seis elétrons na camada de valência, nessa molécula, há dois ligantes iguais e quatro nuvens (duas ligações e dois pares de elétrons não ligantes). Assim, trata-se de uma molécula polar.
VIII- Na molécula de dicloreto de berílio, o berílio realiza duas ligações simples, uma com cada hidrogênio. Como ele apresenta dois elétrons na camada de valência, nessa molécula, existem dois ligantes iguais e duas nuvens (duas ligações) eletrônicas. Portanto, é uma molécula apolar.




.jpg)
.jpg)
.jpg)