Questão 1
Um adolescente, ao tirar uma garrafa de água da geladeira e deixá-la sobre a pia, nota, após pouco tempo, a formação de uma camada de gotículas de água ao redor de sua superfície externa. Esse fenômeno ocorre pela:
A) sublimação do vapor d’agua no ar.
B) condensação do vapor d’água no ar.
C) evaporação do vapor d’água no ar.
D) fusão do vapor d’água no ar.
Questão 2
Para fazer café é necessário aquecer água em uma chaleira, até que saia vapor pelo seu bico. Nesse ponto, desliga-se a chama do fogão e dá-se continuidade ao processo. A saída do vapor ocorre pela
A) fusão da água dentro da chaleira.
B) condensação do vapor d’água.
C) evaporação da água dentro da chaleira.
D) sublimação do vapor d’água.
Questão 3
Uma pessoa, que começa a morar sozinha, percebe que as roupas no varal demoram muito mais tempo para secarem durante o inverno. Ao lembrar de suas aulas de Física, essa pessoa entende que
A) a evaporação da água é mais lenta.
B) o calor latente da água muda em temperaturas mais baixas.
C) o ponto de ebulição no frio é mais alto.
D) a condensação da água é mais rápida.
Questão 4
Um atendente de fast food coloca, por padrão, uma quantidade de gelo junto ao refrigerante em temperatura quase ambiente. Porém os clientes relatam que, após pouco tempo, só resta líquido no copo. Isso ocorre devido à
A) evaporação do gelo por conta da troca de calor com o ar e o líquido.
B) fusão do gelo por conta da troca de calor com o líquido.
C) fusão do líquido por conta da troca de calor com o gelo.
D) evaporação do líquido por conta da troca de calor com o gelo.
Questão 5
O uso de filtros de barro, principalmente em regiões de clima árido, é uma tecnologia importante para manter a água potável fresca e numa temperatura confortável. Isso ocorre por conta da
A) condensação da água nas paredes do recipiente de barro.
B) vaporização da água, absorvendo calor do ambiente.
C) sublimação da água em contato com o ar ambiente.
D) sublimação da água em contato com a superfície de barro.
Questão 6
Um profissional, contratado para montar uma cena de filme no estúdio, nota que o gelo seco posicionado em uma região não forma uma poça de líquido ao seu redor, ao contrário do gelo convencional. O processo de mudança de estado do gelo seco é a
A) sublimação em contato com o ar.
B) evaporação em contato com o ar.
C) condensação em contato com o ar.
D) fusão em contato com o ar.
Questão 7
Para cozinhar feijão, e outros grãos que sejam mais rígidos, é comum usar a panela de pressão. Em seu interior, é possível que a água atinja temperaturas acima de 100 °C, pois
A) a alta pressão dentro da panela impede a fusão da água.
B) a alta pressão dentro da panela impede a ebulição da água.
C) a alta pressão dentro da panela muda o calor latente da água.
D) a alta pressão dentro da panela muda o calor específico da água.
Questão 8
Uma criança esquece no congelador uma garrafa de água completamente cheia. Ao lembrar-se da garrafa, a criança nota que ela se encontra toda deformada após o congelamento da água. Isso ocorreu pois
A) a água líquida criou bolhas em seu interior durante o congelamento.
B) o plástico se contraiu durante o congelamento.
C) a água sofreu sublimação dentro do congelador.
D) a água sólida ocupa um espaço físico maior que a água líquida.
Questão 9
(PUC) Em um calorímetro perfeito, colocam-se 500 ml de água a 60 °C e uma fina tira de 40 g de aço a 500 °C.
Ao alcançar o equilíbrio térmico, quantos ml de água, em estado líquido, estão presentes?
Dados:
Calor específico da água = 1,0 cal/g°C
Calor latente de ebulição da água = 540 cal/g
Calor específico do aço = 0,10 cal/g°C
Densidade da água = 1 g/cm3
A) 0
B) 135
C) 270
D) 360
E) 500
Questão 10
(Ufscar / Unicamp indígena) Num laboratório de termodinâmica foi feito um experimento de calorimetria no qual 30 g de gelo foram transformados em água, obedecendo a curva de aquecimento fornecida no gráfico a seguir.
De acordo com o experimento, assinale a alternativa correta.
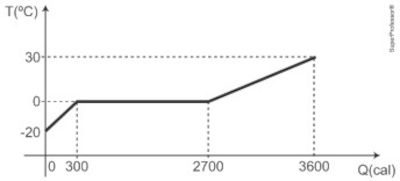
A) O calor específico do gelo é 1,0 cal/g·°C.
B) O calor latente de fusão do gelo é 80,0 cal/g.
C) O calor específico da água é 0,5 cal/g·°C.
D) Para transformar gelo em água sem alterar a temperatura, é preciso uma quantidade de calor igual a 2700 cal.
Questão 11
(FMJ) Uma pessoa colocou 4 pedras de gelo, de 15 g cada uma e todas inicialmente a 0 °C, em um copo de suco de laranja e observou que todo o gelo derreteu em 20 minutos. Considerando o calor latente de fusão do gelo igual a 3,3 x 105 J/kg e desprezando as perdas de calor, a quantidade de calor absorvido pelas pedras de gelo, por unidade de tempo, foi, em média e aproximadamente, de:
A) 2,5 x 102 J/min
B) 1,0 x 103 J/min
C) 2,0 x 104 J/min
D) 2,5 x 104 J/min
E) 1,0 x 105 J/min
Questão 12
(Eear) Um estudante irá realizar um experimento de física e precisará de 500 g de água a 0 °C. Acontece que ele tem disponível somente um bloco de gelo de massa igual a 500 g e terá que transformá-lo em água. Considerando o sistema isolado, a quantidade de calor, em cal, necessária para que o gelo derreta será:
Dados: calor de fusão do gelo = 80 cal/g·°C
A) 40
B) 400
C) 4000
D) 40.000
Resposta Questão 1
Alternativa B.
Ao entrar em contato com a superfície gelada da garrafa, o vapor d’água passa por um processo de condensação, indo do estado gasoso para o estado líquido.
Resposta Questão 2
Alternativa C.
Ao atingir seu ponto de ebulição, a água dará início a seu processo de evaporação (ou ebulição).
Resposta Questão 3
Alternativa A.
Em temperaturas mais baixas, o processo de evaporação é mais lento, pois as trocas de calor são menos intensas.
Resposta Questão 4
Alternativa B.
Devido ao líquido estar na temperatura ambiente, as trocas de calor colocarão o gelo em um processo de fusão, derretendo-o completamente.
Resposta Questão 5
Alternativa B.
A parede porosa do barro permite que haja uma constante vaporização da superfície da água. Tal processo permite que se crie um fluxo de calor, diminuindo a temperatura local do líquido dentro do recipiente.
Resposta Questão 6
Alternativa A.
O gelo seco não é simplesmente água no estado sólido. Na realidade, é dióxido de carbono sólido, que passa do estado sólido diretamente para o estado gasoso.
Resposta Questão 7
Alternativa B.
A pressão interna aumenta com o aquecimento, o que muda também o ponto de ebulição da água.
Resposta Questão 8
Alternativa D.
A água, ao congelar, ocupa um espaço maior, já que o gelo tem uma estrutura molecular menos densa. O que pode, no final, deformar o recipiente de água.
Resposta Questão 9
Alternativa E.
Quantidade de calor necessária para que a água chegue à temperatura de ebulição:
\(Q_1=m_1c_1\Delta \theta _1\\ Q_1=500\cdot 1\cdot(100-60)\\ Q_1=20.000 cal\)
Quantidade de calor que a tira de aço pode fornecer:
\(Q_2=m_2c_2\Delta \theta _2\\ Q_2=40\cdot 0,1\cdot 100-500\\ Q_2=-1600 cal\)
Portanto, a água não entra em ebulição, restando 500 ml de água no estado líquido após o equilíbrio térmico.
Resposta Questão 10
Alternativa B.
\(\Delta Q = m L_f \Rightarrow L_f = \frac{\Delta Q}{m} = \frac{2700 - 300}{30} = \frac{2400}{30} \Rightarrow \boxed{L_f = 80\ \text{cal/g}} \)
Resposta Questão 11
Alternativa B.
Calor necessário para derreter as pedras de gelo:
\(Q = mL \\ Q = 4 \cdot 0{,}015 \cdot 3{,}3 \cdot 10^5 \\ Q = 19.800\ \text{J} \)
Portanto, a quantidade de calor absorvido por unidade de tempo foi de:
\(P = \frac{Q}{\Delta t} \\ P = \frac{19.800}{20} \\ \therefore P \cong 1 \cdot 10^3\ \text{J/min}\)
Resposta Questão 12
Alternativa D.
\(Q = m \cdot L \Rightarrow Q = 500 \cdot 80 \Rightarrow Q = 40.000\ \text{cal} \)



